Antecedentes Previos: Modelo atómico de Thomson
Desde principios de 1900 ya se conocían dos características de los átomos: contienen electrones y son eléctricamente neutros. Para que un átomo sea neutro debe contener el mismo número de cargas positivas y negativas. Thomson propuso que un átomo podía visualizarse como una esfera uniforme cargada positivamente, dentro de la cual se encontraban los electrones como si fueran las pasas en un pastel. Este modelo, llamado “modelo del budín de pasas”, se aceptó como una teoría durante algunos años.
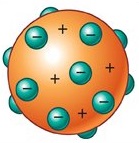
Modelo Atomico de Thomson
Modelo atómico de Thomson, algunas veces llamado el modelo “del budín de pasas” por su semejanza con el tradicional postre inglés que contiene pasas, los electrones están insertos en una esfera uniforme cargada positivamente.
Experimento de Ernest Rutherford
En 1910 un físico neozelandés. Ernest Rutherford, que estudio con Thomson en la Universidad de Cambridge, utilizó partículas alfa para demostrar la estructura de los átomos. Junto con su colega Hans Geiger y un estudiante de licenciatura llamado Ernest Marsden. Rutherford efectuó una serie de experimentos utilizando láminas muy delgadas de oro y de otros metales, como blanco de partículas a provenientes de una fuente radiactiva. Ellos observaron que la mayoría de las partículas atravesaban la lámina sin desviarse, o bien con una ligera desviación. De vez en cuando, algunas partículas alfa eran dispersadas (o desviadas) de su trayectoria con un gran ángulo. En algunos casos, las partículas alfa regresaban por la misma trayectoria hacia la fuente radiactiva. Éste fue el descubrimiento más sorprendente ya que. Según el modelo de Thomson, la carga positiva del átomo era tan difusa que se esperaría que las partículas a atravesaran las láminas sin desviarse o con una desviación mínima, El comentario de Rutherford sobre este descubrimiento fue el siguiente:
Resultó tan increíble como si usted hubiera lanzado una bala de 15 pulgadas hacia un trozo de papel de seda y la bala se hubiera regresado hacia usted.
Tiempo después, Rutherford pudo explicar los resultados del experimento de la dispersión de partículas a utilizando un nuevo modelo de átomo. De acuerdo con Rutherford, la mayor parte de los átomos debe ser espacio vacío. Esto explica por qué la mayoría de las partículas a atravesaron la lámina de oro sufriendo poca o ninguna desviación. Rutherford propuso que las cargas positivas de los átomos estaban concentradas en un denso conglomerado central dentro del átomo, que llamó núcleo. Cuando una partícula “A” pasaba cerca del núcleo en el experimento, actuaba sobre ella una gran fuerza de repulsión, lo que originaba una gran desviación. Más aún, cuando una partícula “A” incidía directamente sobre el núcleo, experimentaba una repulsión tan grande que su trayectoria se invertía por completo.
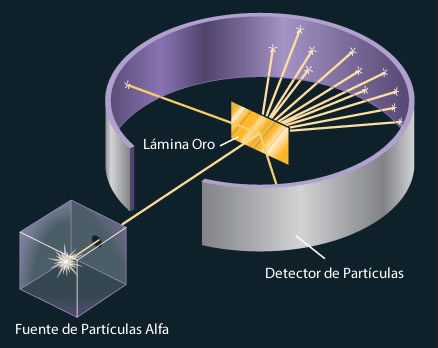
Diseño experimental de Rutherford para medir la dispersión de las partículas alfa causada por una lámina de oro. La mayoría de las partículas alfa atraviesan la lámina de oro con poca o ninguna desviación. Algunas se desvían con un ángulo grande ocasionalmente alguna partícula invierte su trayectoria.
Las partículas del núcleo que tienen carga positiva reciben el nombre de protones. En otros experimentos se encontró que los protones tienen la misma cantidad de carga que los electrones y que su masa es de 1.67262 × 10-24 g. Aproximadamente 1840 veces la masa de las partículas con carga negativa, los electrones. Hasta este punto, los científicos visualizaban el átomo de la siguiente manera: la masa del núcleo constituye la mayor parte de la masa total del átomo, pero el núcleo ocupa solamente 1/1013 del volumen total del átomo.
Las dimensiones atómicas (y moleculares) se expresarán aquí, de acuerdo con el SI (Sistema Internacional), con una unidad llamada picómetro (pm), donde: 1 pm = 1 × 10-12 m.
El radio de un átomo es aproximadamente de 100 pm, mientras que el radio del núcleo atómico es solamente de 0.005 pm. Se puede apreciar la diferencia relativa entre el tamaño de un átomo y su núcleo imaginando que si un átomo tuviera el tamaño del estadio Astrodomo de Houston, el volumen de su núcleo sería comparable con el de una pequeña canica. Mientras que los protones están confinados en el núcleo del átomo, se considera que los electrones están esparcidos alrededor del núcleo y a cierta distancia de él.