Los resultados de un Análisis Cuantitativo típico se calculan a partir de dos medidas:
- Una es la masa o volumen de la muestra que se analiza.
- La segunda es la medida de alguna cantidad proporcional a la del Analito en la muestra, como la masa o volumen. Esta segunda medida, generalmente, completa el análisis, y su naturaleza sirve de base para clasificar los métodos analíticos.
Algunos métodos que siguen este tipo de análisis son:
- Los métodos gravimétricos determinan la masa del Analito o de algún compuesto relacionado químicamente con él.
- En los métodos volumétricos se cuantifica el volumen de una solución que contiene reactivo suficiente para reaccionar por completo con el Analito.
- Los métodos electroanalíticos comprenden la medición de propiedades eléctricas tales como el potencial, corriente, resistencia y cantidad de carga eléctrica.
- Los métodos espectroscópicos se basan en la medida de la interacción de la radiación electromagnética con los átomos o moléculas del Analito o en determinar la producción de tal radiación por el Analito mismo.
- Por último, un grupo de métodos varios incluyen la medición de cantidades tales como la proporción de masa sobre carga de las moléculas en la espectrometría de masas, porcentaje de descomposición radiactiva, calor que generan las reacciones, porcentaje de reacciones, conductividad térmica de las muestras, actividad óptica e índice refractivo.
El Análisis Cuantitativo Típico
Un Análisis cuantitativo típico incluye la secuencia de pasos que se muestra en el diagrama de flujo de la figura.
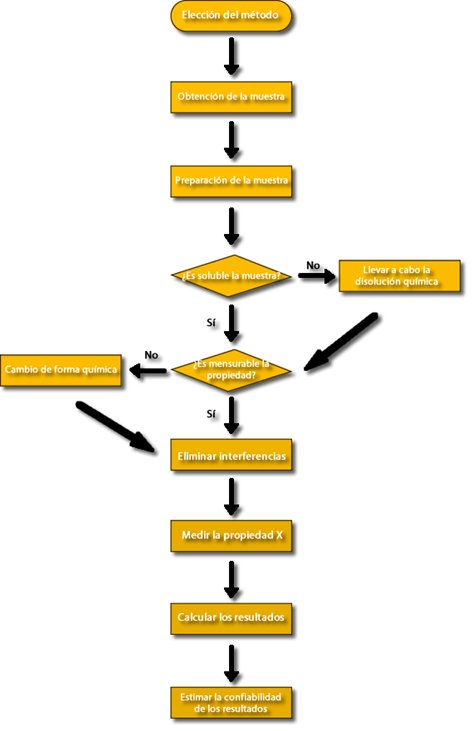
Pasos a Seguir de un Análisis Cuantitativo Típico
Elección del método
El primer paso esencial de todo análisis cuantitativo es la elección de un método. esta decisión a veces es muy difícil y que requiere experiencia al igual que intuición. Uno de los primeros factores que se considera en el proceso de elección es el grado de exactitud necesario. Desgraciadamente, la alta fiabilidad casi siempre requiere invertir mucho tiempo. El método elegido suele ser un término medio entre la exactitud necesaria, por un lado, y el tiempo y dinero disponibles para el análisis, por el otro.
Obtención de la muestra
El paso siguiente del análisis cuantitativo es la obtención de la muestra. A fin de tener información significativa, debe efectuarse el análisis de una muestra que tenga la misma composición que el resto del material del cual se obtuvo.
El muestreo es el proceso para obtener una pequeña masa de un material cuya composición represente con exactitud a todo el material muestreado.
La adquisición de muestras de origen biológico representa un tipo de problema de muestreo. El muestreo de la sangre humana para la determinación de los gases sanguíneos ilustra la dificultad de obtener una muestra representativa de un sistema biológico complejo. La concentración de oxígeno y dióxido de carbono en la sangre depende de diversas variables fisiológicas y ambientales. Por ejemplo, la aplicación incorrecta del torniquete o la flexión de la mano por el paciente puede hacer que fluctúe la concentración sanguínea de oxígeno. Los médicos toman decisiones de vida o muerte basadas en las mediciones de los gases sanguíneos, por lo que se han desarrollado procedimientos estrictos de muestreo y transporte de muestras a los laboratorios clínicos. Esos procedimientos garantizan que la muestra sea representativa del paciente en el momento de su obtención y que su integridad se preserve hasta el momento de su análisis.
Si el muestreo es sencillo como si es complejo, el analista debe cerciorarse de que la muestra en el laboratorio sea representativa antes de proceder al análisis. El muestreo es frecuentemente el paso más difícil y la fuente de mayores errores. La fiabilidad de los resultados finales del análisis no puede ser mayor que la del paso de muestreo.
Preparación de la muestra
Preparación de muestras de laboratorio
Las muestras líquidas presentan una leve diferencia a la vez que relacionada con los problemas en el paso de preparación. Si se permite que estén en recipientes abiertos. el disolvente podría evaporarse y, con ello, se modificaría la concentración del analito.
Definición de réplicas de muestras
Muchos análisis se llevan a cabo con réplicas de muestras, cuya masa o volumen se determinan con mediciones cuidadosas en las que se usa una balanza analítica o un dispositivo volumétrico preciso. La realización de réplicas mejora la calidad de los resultados y constituye una medida de fiabilidad. Las medidas cuantitativas de replicas de muestras suelen promediarse y luego se aplican diversas pruebas estadísticas a los resultados para establecer la fiabilidad.
Preparación de disoluciones: cambios físicos y químicos
La mayoría de los análisis se llevan a cabo en disoluciones de la muestra preparadas con un disolvente adecuado. En teoría el disolvente debe disolver toda la muestra, incluido el analito, de manera rápida y completa. Las condiciones de disolución deben ser tales que resulten imposibles las pérdidas del analito. En el diagrama se plantea la pregunta. Si la muestra es soluble en el disolvente elegido. Desgraciadamente, numerosos materiales que deben analizarse son insolubles en disolventes comunes. Ejemplos de ello son los minerales de silicatos, polímeros de alto peso molecular y especímenes de tejidos animales. En tales circunstancias, debe seguirse el diagrama continuando por el cuadro de la derecha y llevar a cabo su modificación química. La conversión del analito en esos materiales en una forma soluble suele ser la tarea más difícil y larga del proceso analítico. Podría requerirse el calentamiento de la muestra con disoluciones acuosas de ácidos fuertes, bases fuertes. agentes oxidantes, agentes reductores o una combinación de estos reactivos. También podría ser necesaria su ignición al aire o con oxígeno, o la fusión de la muestra a alta temperatura en presencia de diversos flujos. Aun cuando el analito se ha disuelto, cabe preguntarse si la muestra tiene una propiedad que es proporcional a la concentración del analito y que sea mensurable. En caso de no serlo, pueden ser necesarios otros pasos químicos para la conversión del analito en una forma susceptible de medida.
Eliminación de interferencias
Una vez que la muestra está en disolución y se ha convertido el analito en una forma apropiada para su medida el paso siguiente es eliminar sustancias de la muestra que interfieran en su medida. Pocas propiedades químicas o físicas de importancia en el análisis químico son exclusivas de una especie química. Por el contrario. las reacciones utilizadas y las propiedades medidas son características de un grupo de elementos o compuestos. Las especies ajenas al analito con efecto en la medida final se llaman interferencias o interferentes. Debe idearse un plan para aislar los analitos de las interferencias antes de emprender la medida final. No se cuenta con reglas generales para la eliminación de interferencias; de hecho, la resolución de este problema puede ser el aspecto más difícil de un análisis.
Calibración y medida de la concentración
Todos los resultados analíticos dependen de una medición final X de una propiedad física o química de un analito. Esta propiedad varía de manera conocida y reproducible con la concentración, (Ca) del analito. En teoría, la medida de la propiedad es directamente proporcional a la concentración, es decir:
donde k es una constante de proporcionalidad. Salvo dos excepciones, los métodos analíticos que requieren la determinación empírica de A con estándares o patrones químicos cuya Ca es conocida, Así el proceso de determinación de k es un paso importante en la mayoría de los análisis, paso conocido con el nombre de calibración.
Cálculo de los resultados
Calcular las concentraciones de analitos a partir de datos experimentales suele ser relativamente sencillo, en particular con las calculadoras modernas y computadores. Se basa en datos experimentales iniciales obtenidos en el paso de medida, las características de los instrumentos de medida y la estequiometria de la reacción analítica.
Evaluación de resultados por estimación de su fiabilidad
Los resultados analíticos están incompletos sin una estimación de su habilidad. El experimentador debe proporcionar alguna medida de la incertidumbre relacionada con los cálculos obtenidos si se pretende que los datos revistan valor.