Los átomos se combinan entre sí para formar compuestos con propiedades diferentes de los átomos que contienen. La fuerza de atracción entre los átomos en un compuesto, es un enlace químico.
Un tipo de enlace químico, es el enlace iónico. este corresponde a una fuerza de atracción entre especies (iones) con cargas opuestas. Los iones con carga positiva se conocen como cationes; los iones con carga negativa son aniones. El hecho de que un elemento sea la fuente del catión o del anión en un enlace iónico depende de varios factores, para lo cual la tabla periódica puede servir como guía.
Al formar compuestos iónicos, los elementos a la izquierda de la tabla periódica por lo general pierden electrones, y forman un catión que tiene la misma configuración electrónica que el gas noble más cercano. La pérdida de un electrón del sodio, por ejemplo, produce Na+, el cual tiene la misma configuración electrónica que el neón.
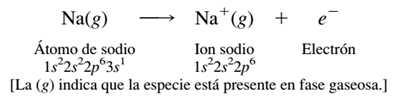
Para sustraer un electrón de cualquier átomo debe agregarse una gran cantidad de energía, llamada energía de ionización. La energía de ionización del sodio, por ejemplo, es 496 kJ/mol (119 kcal/mol).
Se dice que los procesos que absorben energía son endotérmicos. Comparado con otros elementos, el sodio y los elementos del grupo 1A tienen energías de ionización relativamente bajas. En general, la energía de ionización aumenta a lo largo de una fila en la tabla periódica.
Los elementos a la derecha de la tabla periódica tienden a ganar electrones para alcanzar la configuración electrónica del siguiente gas noble superior. Al agregar un electrón al cloro, por ejemplo, se forma el anión Cl–, el cual tiene la misma configuración electrónica de capa completa que el gas noble argón.

Cuando un átomo de cloro captura un electrón se libera energía. Las reacciones que liberan energía se describen como exotérmicas, y el cambio de energía para un proceso exotérmico tiene signo negativo. El cambio de energía para la adición de un electrón a un átomo se conoce como su afinidad electrónica y es 349 kJ/mol (83.4 kcal/mol) para el cloro.
La transferencia de un electrón de un átomo de sodio a un átomo de cloro produce un catión sodio y un anión cloro, los cuales tienen una configuración electrónica de gas noble:
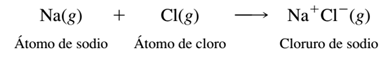
Si tan sólo se suman la energía de ionización del sodio (496 kJ/mol) y la afinidad electrónica del cloro (349 kJ/mol), se concluiría que el proceso total es endotérmico por 147 kJ/mol.
La energía liberada al agregar un electrón al cloro es insuficiente para satisfacer la energía requerida para quitar un electrón del sodio. Este análisis, sin embargo, no considera la fuerza de atracción entre los iones con cargas opuestas Na+ y Cl– , la cual excede 500 kJ/mol y es más que suficiente para que el proceso completo sea exotérmico. Las fuerzas de atracción entre partículas con cargas opuestas se denominan atracciones electrostáticas, o coulómbicas, y es el significado de un enlace iónico entre dos átomos.
Los enlaces iónicos son muy comunes en los compuestos inorgánicos, pero raros en los orgánicos. La energía de ionización del carbono es demasiado grande y la afinidad electrónica demasiado pequeña para que el carbono forme un anión o catión.