Desde la Antigüedad el hombre ha intentado entender por qué y cómo se producen los fenómenos naturales que observa a su alrededor. Este anhelo de comprensión ha dado origen a diversas corrientes de pensamiento, como la religión, el arte o la ciencia. En este articulo nos centraremos en una de las muchas ramas en las que está dividida la ciencia: la química.
La química es una ciencia natural mediante la cual el hombre estudia la composición y el comportamiento de la materia, así como la relación de ésta con la energía.
Pero, comprender los fenómenos naturales no solo le ha servido a la humanidad para satisfacer su curiosidad. También ha servido para mejorar la calidad de vida de las personas. Así, materiales como plásticos, pinturas o detergentes; medicamentos como la penicilina, los antiácidos o la insulina, y máquinas como los refrigeradores o los motores de combustión interna, han sido posibles gracias al creciente conocimiento que tenemos del mundo a nuestro alrededor y muy especialmente gracias a los avances alcanzados en la química.
Contenidos de la página
La Química a través la Historia
Las primeras manifestaciones del ser humano relativas a la química se relacionan con actividades prácticas, como la cocción de alimentos y la metalurgia. Para el año 1200 a. de C. egipcios y babilonios habían alcanzado gran perfección en la aplicación de estas técnicas, siendo maestros en el manejo del vidrio y de metales como el oro, la plata y el hierro. No obstante, estos pueblos dieron poca importancia a la elaboración de una base teórica que soportara estos quehaceres cotidianos.
En el siglo VI a. de C. surgen en Grecia las primeras teorías sobre la composición de la materia, gracias a filósofos como Tales de Mileto (625-545 a. de C.) y Anaximandro (611-547 a. de C.). Sus ideas fueron retomadas más tarde por Aristóteles (383-322 a. de C.) en la denominada teoría de los cuatro elementos, según la cual, tierra, agua, aire y fuego, al combinarse conformaban la materia y definían las cualidades fundamentales de los cuerpos. Años después, en el siglo V a. de C., Demócrito y Leucipo propusieron que la materia estaba compuesta por unas partículas mínimas indivisibles, a las que llamaron átomos.
La alquimia (500-1600 d. de C.)
Como resultado de la fusión entre el dominio técnico de los egipcios y la elaboración teórica y filosófica de los griegos, surgió la alquimia. Los alquimistas, a diferencia de sus predecesores, no solo deseaban comprender el mundo natural, sino que además buscaban la perfección en sí mismos. Este ideal se hallaba materializado en el oro. Por ello, los alquimistas encaminaron gran parte de sus esfuerzos a la manipulación de los metales y de un sinnúmero de sustancias con capacidad para interactuar con éstos y especialmente a la búsqueda de la piedra filosofal, compuesto mágico que podía transformar los metales en oro, así como proporcionar la eterna juventud.
Por esta senda, desarrollaron y perfeccionaron diversos instrumentos y métodos, los cuales han llegado a nosotros a través de términos como alcohol, baño de María, alambique, destilación y sublimación.
Surgimiento de la química moderna
Para los hombres de ciencia del siglo XVIII, la teoría de los cuatro elementos ya no era suficiente para explicar la composición y el comportamiento de la materia. Por ejemplo, los avances en el conocimiento de los gases ponían en duda que el aire fuera un elemento en lugar de un conjunto de diferentes sustancias.
Era una época en la que nada se daba por sentado, todo debía ser medido, pesado y comprobado. El representante más destacado de esa tendencia fue el químico francés Antoine Lavoisier (1743-1794), quien sentó las bases de la química moderna, al establecer que la materia no se crea ni se destruye, sino que se transforma, y demostrar que el aire, el agua y el fuego no eran elementos.
Siglos XIX y XX
Durante el siglo XIX la investigación en química se centró en dilucidar la naturaleza de la materia. Así, John Dalton (1766-1844) presenta la primera propuesta consistente sobre la estructura atómica, que luego es complementada por Ernest Rutherford (1871-1937), con lo cual empieza a entreverse que el átomo se compone de partículas más pequeñas y que no es indivisible, como lo indica su nombre. Basado en estos trabajos, Niels Bohr (1885-1962) propone el sistema planetario del átomo, modelo precursor del aceptado actualmente.
Basado en todo el conocimiento acumulado sobre los elementos químicos, Dimitri Mendeleiev (1834-1907) organiza la tabla periódica de los elementos, con base en sus pesos atómicos.
El siglo XX es un período de grandes cambios. En 1905, Albert Einstein (1879-1955) presenta la teoría de la relatividad, con lo cual sacude las bases teóricas de la física y la química. En las primeras décadas del siglo, los esposos Marie y Pierre Curie estudian el fenómeno de la radiactividad y descubren dos nuevos elementos: el radio y el polonio.
En la segunda mitad del siglo XX la atención de los químicos se enfoca hacia el estudio de las partículas subatómicas y la fabricación sintética de diversos materiales, como los plásticos y los superconductores.
Finalmente, el misterio de la vida encabeza las investigaciones en genética y biología molecular. Así, en 1953, Francis Crick y James Watson resuelven la estructura tridimensional de la molécula de ADN (ácido desoxirribonucleico), base para comprensión del lenguaje de la vida. Posteriormente, en 1996, es presentado al mundo el primer organismo clonado. Es así como la humanidad recibe el siglo XXI con un complejo pero inevitable conflicto ético relacionado con el papel de la ciencia en la sociedad.
¿Cómo trabajan los científicos?
El desarrollo del conocimiento científico, es decir, la creciente comprensión que tenemos del mundo que nos rodea, se basa en la experimentación y en el posterior planteamiento de explicaciones, que a su vez son la base para la construcción de teorías científicas.
Al analizar un determinado fenómeno, intentando establecer por qué motivo se produce, qué factores intervienen en él, qué relación tiene con otros fenómenos, etc., se puede proceder de dos maneras. En algunos casos basta con realizar una descripción detallada del fenómeno, sin necesidad de hacer mediciones, por esto se dice que es un trabajo cualitativo. En otros casos, es necesario realizar mediciones, precisas y rigurosas para formular matemáticamente las observaciones y las conclusiones derivadas de estas. Se dice entonces que el trabajo científico es cuantitativo.
Finalmente, un aspecto muy importante del trabajo científico es que se lleva a cabo en equipo. Actualmente, el conocimiento acumulado es tan vasto, que es imposible que una sola persona pueda conocer todas las áreas. Por este motivo, es necesario que cada especialista aporte sus conocimientos al equipo para abordar los objetos de estudio de manera interdisciplinaria.
Metodología científica
No existe una metodología única para desarrollar un proceso científico. Cada área del conocimiento tiene sus propios métodos, sus propias estrategias y enfrenta los problemas de su área desde distintos ángulos; sin embargo, todas se rigen por unos principios comunes. En el caso de las ciencias experimentales como la química, la biología y la física casi siempre emplean un método común, en el cual se pueden diferenciar las siguientes etapas:
- Observación de fenómenos: la observación es la base del trabajo científico. Observamos para entender por qué o cómo ocurren los fenómenos. Utilizamos nuestros sentidos y diversos instrumentos de medida para observar y luego de haber realizado anotaciones y mediciones repetidas veces, podemos plantear preguntas concretas.
- Formulación de preguntas: por ejemplo, ¿por qué cuando mezclo dos compuestos obtengo un tercero de otro color? Es muy importante que las observaciones que hagamos puedan ser reproducidas y confirmadas por otras personas. Una vez se ha definido el fenómeno que se quiere estudiar, en primer lugar se debe observar su aparición, las circunstancias en las que se produce y sus características.
- Revisión de trabajos previos: consiste en consultar diversas fuentes para informarse acerca de lo que se conoce hasta el momento sobre el tema que se va a tratar. Por esta razón se dice que la ciencia es acumulativa, pues los nuevos conocimientos se construyen sobre los anteriores y de esta manera se van ampliando.
- Formulación de hipótesis: consiste en proponer respuestas a las preguntas que nos habíamos formulado anteriormente, es decir, se trata de idear posibles explicaciones del fenómeno observado.
- Comprobación experimental de la hipótesis: consiste en intentar probar si la hipótesis planteada logra explicar satisfactoriamente el fenómeno en cuestión. Para ello se diseña un experimento, durante el cual se realizan nuevas observaciones, pero bajo condiciones controladas.
- Controlar variables: es posible discernir el efecto de tal o cual factor sobre el desarrollo del fenómeno. Por ejemplo, si adiciono diferentes cantidades de una de las dos sustancias, ¿cambia el resultado? Cuando hablamos de controlar las condiciones nos referimos a definir intencionalmente ciertas variables que creemos puedan afectar el desarrollo del fenómeno. En nuestro ejemplo, las variables por controlar podrían ser la temperatura o la cantidad presente de cada sustancia.
- Planteamiento y divulgación de las conclusiones: las observaciones y datos obtenidos en el experimento constituyen resultados concretos que deben ser analizados con el fin de determinar si corroboran o no la hipótesis y plantear luego las conclusiones.
En caso afirmativo, la hipótesis generará una teoría científica, es decir, una explicación que da razón de lo observado. De lo contrario se procede a replantearla y a diseñar nuevos experimentos. Las conclusiones deben ser comunicadas al resto de la comunidad científica, con el fin de generar discusiones y permitir que sean utilizadas como punto de partida para otros descubrimientos o como fundamento para aplicaciones tecnológicas. - Elaboración de leyes. Después de una serie de experimentos, es posible evidenciar regularidades y relaciones entre diferentes sucesos que se enuncian de manera concisa y matemática en forma de leyes científicas. A diferencia de una teoría que está constituida por una serie de hipótesis que conforman un sistema deductivo y proporcionan explicaciones a un acontecimiento, una ley es descriptiva, no explicativa y se aplica a un conjunto bien definido de fenómenos, por lo que no puede tomarse como una verdad absoluta.
La medición
Los químicos caracterizan los procesos e identifican las sustancias mediante la estimación de ciertas propiedades particulares de estos. Para determinar muchas de esas propiedades es necesario tomar mediciones físicas.
Medir es comparar la magnitud física que se desea cuantificar con una cantidad patrón que se denomina unidad. El resultado de una medición indica el número de veces que la unidad está contenida en la magnitud que se mide.
Las Magnitudes Físicas
No todos los rasgos que caracterizan un cuerpo o un determinado fenómeno pueden ser cuantificados. Por ejemplo, el olor y el sabor no pueden ser estimados objetivamente, sino que dependen de la apreciación de diferentes individuos. Aquellos rasgos que pueden ser medidos se denominan magnitudes físicas. Existen dos tipos de magnitudes físicas:
- Magnitudes fundamentales: son aquellas que no dependen de ninguna otra medida, expresan simplemente el número de veces que está la unidad patrón en lo que se desea medir, como por ejemplo la masa, la temperatura o la longitud.
- Magnitudes derivadas: son aquellas que se expresan como la relación entre dos o más magnitudes fundamentales. Por ejemplo, la densidad indica la cantidad de masa presente en una cierta unidad de volumen.
El Sistema Internacional de Unidades
Las primeras mediciones se basaron probablemente en el cuerpo humano, por ejemplo expresando la longitud en pies. Luego, diferentes regiones estandarizaron unidades para su uso exclusivo. Cuando empezó a hacerse común el intercambio de conocimiento entre regiones, hacia mediados del siglo XIX, esta diversidad en la manera de medir se convirtió en un serio inconveniente. Para solucionar estos problemas la Academia de Ciencias de Francia creo el Sistema Internacional de Unidades (SI), según el cual existen siete magnitudes fundamentales, a partir de las cuales es posible expresar cualquier otra magnitud derivada.
Sin embargo, también es empleado el sistema inglés, en donde se utilizan: el pie, la pulgada y la milla como unidades de longitud; la libra, como unidad de masa; el segundo, como unidad de tiempo; el grado Fahrenheit, como unidad de temperatura y el BTU, como unidad de presión.
| Magnitud | Unidad | Símbolo |
| Longitud | Metro | m |
| Masa | Kilogramo | kg |
| Tiempo | Segundo | s |
| Temperatura | Kelvin | K |
| Corriente eléctrica | Amperio | A |
| Cantidad de materia | Mol | mol |
| Intensidad lumínica | Candela | cd |
| Magnitud | Definición de la magnitud | Unidad |
| Superficie | Extensión en que se consideran sólo dos dimensiones. Se calcula mediante la unidad de longitud elevada al cuadrado. | Metro cuadrado (m2) |
| Volumen | Espacio ocupado por un cuerpo. Se calcula mediante la unidad de longitud elevada al cubo. | Metro cúbico (m3) |
| Densidad | Cantidad de masa por unidad de volumen. | kg/metro cúbico (kg/m3) |
| Velocidad ^de reacción | Cantidad de partículas formadas o desaparecidas por unidad de tiempo. | moles formados/segundo (mol/s) |
Equivalencia entre unidades
No siempre utilizamos el SI de unidades. Con frecuencia, y especialmente en química empleamos unidades muy pequeñas, así por ejemplo expresamos la masa en gramos o miligramos (mg), o la longitud en micras (m) o nanómetros (nm).
En estos casos debemos transformar unas unidades en otras equivalentes. La solución de estos inconvenientes está en el empleo de múltiplos y submúltiplos de las respectivas unidades.
En la figura se presenta una tabla que contiene los prefi jos más comunes y su respectiva equivalencia. Para transformar la unidad en que se expresa la medida de una magnitud fundamental en su correspondiente unidad SI, basta conocer los múltiplos y submúltiplos de dicha unidad.
Así, por ejemplo, si queremos transformar 5 metros en centímetros, debemos saber que un metro equivale a 100 centímetros y por lo tanto los 5 metros equivalen a:
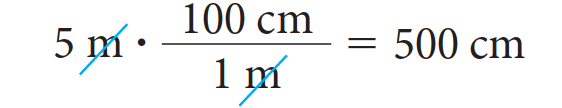
Si el caso corresponde a una magnitud derivada debemos considerar su definición y luego aplicar la transformación a cada una de las magnitudes fundamentales que la definen.
| Múltiplos del SI | ||
| Prefijo | Símbolo | Factor |
| exa | E | 1018 |
| penta | P | 1015 |
| tera | T | 1012 |
| giga | G | 109 |
| mega | M | 106 |
| kilo | k | 103 |
| hecto | h | 102 |
| deca | da | 10 |
| Submúltiplos del SI | ||
| Prefijo | Símbolo | Factor |
| deci | d | 10-1 |
| centi | c | 10“2 |
| mili | m | 10-3 |
| micro | P- | 10-6 |
| nano | n | 10-9 |
| pico | P | 10-12 |
| femto | f | 10-15 |
| atto | a | 10-18 |
Temperatura y calor
Como vimos anteriormente, la temperatura es una de las magnitudes fundamentales definidas por el SI. Se trata de una magnitud difícil de definir y que tiende a confundirse con el concepto de calor, aunque todos probablemente tenemos una idea más o menos intuitiva de calor y temperatura. Para dar claridad a este respecto vamos a profundizar un poco más en ambos conceptos.
Desde la Antigüedad se sabe que la materia está formada por partículas pequeñas llamadas átomos y moléculas, que dependiendo del estado en que se encuentre la materia, sus átomos o moléculas se hallan en mayor o menor grado de libertad. El grado de libertad depende de las fuerzas que existan entre los átomos o moléculas; si las moléculas se mueven es porque poseen energía bien sea potencial o cinética.
De la misma manera que todas las personas que se encuentran alrededor de una fogata no experimentan el mismo grado de calor, tampoco todas las moléculas de un cuerpo tienen la misma energía; unas se mueven más rápido que otras, de tal manera que si queremos expresar de alguna forma la energía del cuerpo, tenemos que hacerlo mediante un valor que corresponda a la energía promedio de sus moléculas. Pues bien, el concepto que se puede deducir del ejemplo anterior es el de temperatura. La temperatura de un cuerpo se define como una magnitud que mide la energía promedio de las moléculas que constituyen ese cuerpo. La temperatura de un cuerpo es independiente de su masa, porque solo depende de la velocidad y la masa de cada una de sus moléculas. De otra parte, el concepto de calor corresponde a la medida de la energía que se transfi ere de un cuerpo a otro debido a la diferencia de temperatura que existe entre ellos.
Unidades de cantidad de calor
Siendo el calor una forma de energía, que se transfiere de una sustancia a otra en virtud de una diferencia de temperatura, se puede determinar la cantidad de calor midiendo el cambio de temperatura de una masa conocida que absorbe calor desde alguna fuente.
Según el SI el calor se mide en julios, que es una unidad de energía, no obstante, la caloría es más comúnmente empleada en todo el mundo.
Una caloría se define como la cantidad de calor necesaria para elevar la temperatura de un gramo de agua de 14,5° a 15,5°, equivale a 4,184 julios. Frecuentemente se emplea un múltiplo de la caloría, denominado kilocaloría, que equivale a 1.000 calorías.
¿Cómo medimos la temperatura?
El termómetro, es un capilar terminado en un bulbo que contiene el líquido que se dilata; está cubierto por un tubo externo que contiene la escala numérica.
La mayoría de los materiales conocidos se expanden, es decir, experimentan un aumento de volumen, cuando su temperatura aumenta, y se contraen cuando esta disminuye. El termómetro es un instrumento diseñado para medir la temperatura valiéndose de la expansión y contracción de un líquido, que generalmente es mercurio.
Escalas termométricas Existen varias escalas de temperatura. Para definir una escala se establecen arbitrariamente dos puntos de referencia que indican los extremos de la escala. La distancia entre estos puntos se divide entre un número definido de partes a las que se llama grados.
Algunas de las escalas termométricas más utilizadas son:
- Escala Celsius o centígrada (°C). Denominada así en honor a su inventor Anders Celsius, esta escala emplea como puntos de referencia los puntos de congelación y de ebullición del agua, asignando un valor de cero al primero y de 100 al segundo. Debido a la asignación arbitraria del punto cero, en esta escala son posibles las temperaturas negativas, correspondientes a valores por debajo del punto de congelación del agua.
- Escala Kelvin o absoluta (K). Con el fin de evitar el empleo de valores negativos de temperatura, Lord Kelvin sugirió emplear como punto de inicio de la escala un valor conocido como cero absoluto, que corresponde a una temperatura de 273 °C, en la cual la energía cinética de las partículas es ínfi ma y por lo tanto corresponde a la temperatura más baja que se puede lograr. El tamaño de los grados en las escalas Kelvin y Celsius es el mismo, lo cual facilita la conversión de valores entre una y otra, como veremos más adelante.
- Escala Fahrenheit (°F). Esta escala se emplea comúnmente en los Estados Unidos y se diferencia de las anteriores en que al punto de congelación del agua se le asigna un valor de 32° y al de ebullición, 212°. Esto quiere decir que la diferencia de temperatura entre los dos puntos de referencia se compone de 180 partes o grados, en lugar de 100, como en las escalas Celsius y Kelvin. De esta manera, el tamaño relativo de un grado centígrado o Kelvin es mayor que el de un grado Fahrenheit.
- Escala Rankine (°R). En esta escala el intervalo entre el punto de congelación y de ebullición del agua es igual al intervalo que existe entre estos puntos en la escala Fahrenheit. La diferencia está en que el punto de congelación del agua se marca como 492°, mientras que el punto de ebullición se señala como 672°; el cero absoluto de esta escala corresponde al cero absoluto de la escala Kelvin. La escala Rankine es muy empleada en el campo de la ingeniería.