Desde 1869, cuando Lothar Meyer publicó la tabla de volúmenes atómicos en función de la masa atómica, comenzaron a sistematizarse las propiedades atómicas. A partir de entonces se encontraron numerosas propiedades en los elementos que variaban según su estructura electrónica, y que se relacionaban fundamentalmente con la configuración electrónica externa del átomo.
Las propiedades periódicas físicas más interesantes y que, primeramente, captaron atención científica fueron: el volumen atómico, el radio iónico, y la densidad. Tiempo más tarde, se conocieron las propiedades magnéticas (energía de ionización y afinidad electrónica) y el número de oxidación para un átomo (cuando enlaza).
Toda propiedad periódica depende, exclusivamente, del número atómico y la configuración del nivel externo. Lo interesante es que el comportamiento químico de un átomo, no tiene relación sólo con su naturaleza, sino más bien, con su posición en la Tabla periódica. Previo al análisis de algunas de estas propiedades es importante aclarar que el concepto de periodicidad se relaciona con la variación de alguna propiedad física en función del aumento o disminución del valor de Z.
Así, por tanto, una propiedad no será periódica si no hay correlación entre el valor de Z y la variación de esa propiedad a lo largo de un período.
Las propiedades que se trataran a continuación están relacionadas con Propiedades de Tamaño y Propiedades energéticas.
Propiedades Periódicas asociadas al Tamaño
Propiedades Periódicas Asociadas a la Energía.
Radio Atómico
Conociendo la naturaleza del elemento y el tipo de enlace que puede formar, es posible determinar su tamaño. Si el átomo se le considera una esfera rígida, el volumen viene dado por la ecuación
Donde r es el radio del átomo o distancia entre núcleos o núcleo-electrón. Considerando la naturaleza del elemento se definen 3 conceptos distintos: Radio metálico, Radio covalente y Radio iónico. El valor teórico para el radio se puede determinar asumiendo que:
- Si el átomo es metálico, el radio será la mitad de la distancia entre los centros de dos átomos adyacentes.
- Si el átomo es no-metálico el radio, será la mitad de la distancia entre los centros atómicos de una molécula homogénea diatómica (por ejemplo, Cl2, Br2, N2)
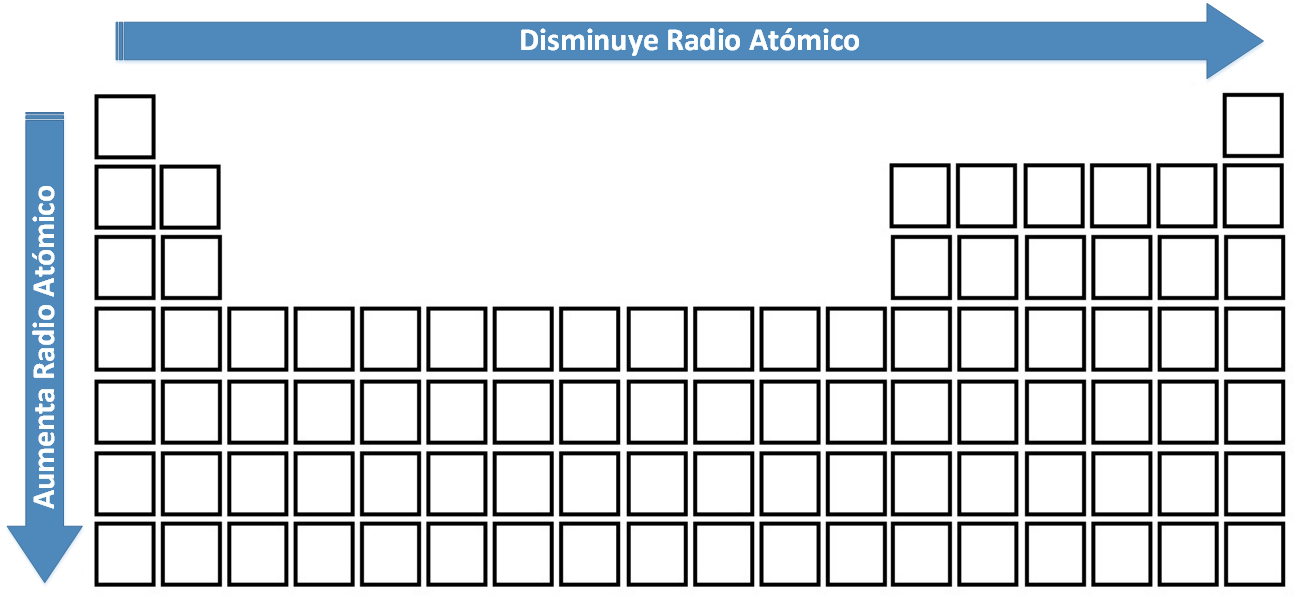
El tamaño y radio de un átomo presentan una relación de proporcionalidad, y apenas han variado desde que fuera publicada por vez primera la Tabla periódica de Lothar Meyer. Considerando que el radio de un átomo depende del valor del número cuántico principal (n), su variación será la siguiente:
- El radio de un átomo aumentará al descender en un grupo o familia: (hay un aumento en el valor de n). Esto porque los electrones se ubicarán en orbitales de mayor tamaño y, por tanto, se hallarán más lejos del núcleo.
- En un período el radio atómico disminuirá de izquierda a derecha: es decir, desde que se comienza a llenar el orbital s1 hasta que culmina en el orbital p6 (en un mismo período). En este caso, los electrones de valencia se sitúan en el mismo nivel de energía, de modo que no habrá aumento en el tamaño. Sin embargo, a medida que nos desplacemos hacia la derecha, aumentará el valor de Z y, por lo tanto, aumentará el número de protones, que ejercerán mayor fuerza de atracción sobre los electrones, acercándolos al núcleo, comprimiendo el átomo y disminuyendo su tamaño.
Carga Nuclear Efectiva (Zef) y la Relación con el Tamaño
Se define Zef como la carga con que el núcleo atrae los electrones más externos. El Zef depende de 2 factores: el número atómico (Z) y el efecto pantalla (S). Los electrones que están más cerca del núcleo (primeros niveles de energía) bloquean la carga positiva del núcleo sobre el resto de electrones. Esto implica que los electrones del último nivel son atraídos con menos fuerza, por lo tanto, la carga total real del núcleo sobre los electrones siempre es menor que la carga teórica.
Ecuación de apantallamiento:
El efecto pantalla (S) se puede determinar mediante la relación de Slater cuya expresión matemática está dada por
Donde:
Nn: número de electrones del nivel de energía más externo (último nivel).
Nn-1: número de electrones del nivel de energía inmediatamente inferior al más externo (penúltimo nivel).
N’: número de electrones restantes que no han sido considerado antes.
Ejemplo
Ejemplo basado en para un ion isoelectrónico del Neón:
Cálculo para F-1 :
F-1 : 1s2, 2s2, 2p6 (Configuracion Electronica)
Z = 9 (Numero Atomico)
S = 0,35 · 8 + 0,85 · 2 = 4,5 (Efecto Pantalla)
Para otros iones se tienen los siguientes datos:
| Z | S | Zef | |
| F-1 | 9 | 4,5 | 4,5 |
| Na+ | 11 | 4,5 | 6,5 |
| Mg+2 | 12 | 4,5 | 7,5 |
| Al+3 | 13 | 4,5 | 8,5 |
En la tabla, se observa que mientras mayor es el zef, menor es el radio iónico, por lo tanto, mientras más positivo es un componente de una serie isoelectrónica, menor será su radio.
En general la variación de Zef en el sistema periódico es la siguiente:
- En un período aumenta hacia la derecha conforme aumenta el valor de Z, debido al apantallamiento de los electrones (aumenta el número de electrones).
- En un grupo permanece casi sin variaciones puesto que aumenta el número de niveles de la misma forma en que aumenta el efecto de apantallamiento.
Radio Iónico
Se define Radio Iónico como el tamaño de una especie química que captó o cedió electrones del nivel de mayor energía. Es muy común comparar el tamaño de esas especies entre sí y con su propio elemento.
Comparación entre Li y Li+1 :
Li: 1s2, 2s1 (2 niveles de energía)
Li+1: 1s2 (1 nivel de energía)
Conclusiones:
- El elemento tiene más niveles de energía que el ion
- El ion tiene menos electrones que el elemento
- El ion tiene menor tamaño que el elemento
[alert-success]El radio de un catión es menor que el radio del átomo neutro, para un mismo elemento.[/alert-success]
Si se trata de un anión, la variación es contraria. La especie con carga eléctrica negativa tiene mayor tamaño que el elemento. Comparemos el átomo de Flúor; F con su anión estable:
F-1 F: 1s2, 2s2 2p5 (presenta 9 electrones y 2 niveles de energía)
F-1: 1s2, 2s2 2p6 (presenta 10 electrones, hay expansión de la nube electrónica)
Conclusiones:
- Ambos (ion y átomo) tienen igual cantidad de niveles de energía
- Ambos tienen igual Z, sin embargo el anión tiene más electrones que el átomo
- La carga nuclear efectiva es mayor en el átomo
- El ion tiene mayor tamaño que el átomo
[alert-success]el radio de un anión es mayor que el radio del átomo neutro, para un mismo elemento[/alert-success]
Radio en Iones Isoelectrónicos
Cuando varios iones tienen la misma configuración electrónica, el tamaño estará definido fundamentalmente por la carga nuclear, es decir, la cantidad de protones es la que se debe considerar para definir qué ion es más grande (o pequeño) que otro.
Considere la siguiente tabla con datos de radios iónicos para algunas especies químicas pertenecientes a la serie isoelectrónica del Neón:
| F1 | Na+ | Mg+2 | Al+3 |
| 1.36 A | 0.95 A | 0.65 A | 0.50 A |
En la tabla se cumple que:
r Al+3 < r Mg+2 < r Na+ < r F-1
Energía de Ionización o Potencial de Ionización
Corresponde a mínima energía necesaria para extraer un electrón desde el estado fundamental o ion gaseoso. El proceso de ionización es siempre endotérmico, de modo que requiere de energía extra para que ocurra. Como el proceso se determina para 1 electrón, pueden existir varios procesos de ionización consecutivos, de modo que se habla de varios potenciales de ionización para un mismo átomo.
Para el átomo de Aluminio, por ejemplo, se cumple que:
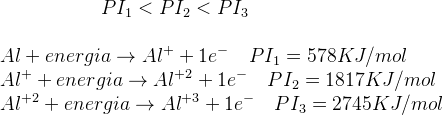
El primer valor de P.I corresponde a la energía necesaria para generar el catión Al+1 y equivale a 578 KJ/mol. El segundo P.I., será la energía requerida para quitar el segundo electrón, y así para la eliminación sucesiva de electrones adicionales. El P.I. se puede medir en Kilocalorías o en electrón-Volt (eV) donde:
1eV = 23,06 Kcal
1 caloría = 4,19 Joule
[alert-success]Los valores observados de energía de ionización dependen de una combinación entre la carga nuclear efectiva, el radio atómico y la configuración electrónica.[/alert-success]
En general el proceso de ionización viene dado por:
Ejemplo
Algunos valores de potenciales de ionización para los elementos del período 3
| Ei – número | Na | Mg | Al | Si | P | S | Cl | Ar |
| Ei1 | 496 | 738 | 578 | 787 | 1,012 | 1,000 | 1,251 | 1,520 |
| Ei2 | 4,562 | 1,451 | 1,817 | 1,577 | 1,903 | 2,251 | 2,297 | 2,665 |
| Ei3 | 6,912 | 7,733 | 2,745 | 3,231 | 2,912 | 3,361 | 3,822 | 3,931 |
| Ei4 | 9,543 | 10,540 | 11,575 | 4,356 | 4,956 | 4,564 | 5,158 | 5,770 |
| Ei5 | 13,353 | 13,630 | 14,830 | 16,091 | 6,273 | 7,013 | 6,540 | 7,238 |
| Ei6 | 16,610 | 17,995 | 18,376 | 19,784 | 22,233 | 8,495 | 9,458 | 8,781 |
| Ei7 | 20,114 | 21,703 | 23,293 | 23,783 | 25,397 | 27,106 | 11,020 | 11,995 |
Consideraciones:
- En los períodos el P.I aumenta al aumentar Z, sin embargo, se observa una disminución entre los grupos IIA y IIIA; grupo VA y VIA por razones de estabilidad entre las configuraciones electrónicas. A pesar de lo anterior, se puede afirmar que conforme aumenta el número atómico en un período, aumenta el valor de la energía de ionización.
- En los grupos, al aumentar Z, el P.I disminuye, esto porque aumenta la distancia entre el núcleo y el último electrón y por lo tanto, la energía de ese último es mayor (cuesta menos la ionización)
Es necesario destacar que los menores valores de PI corresponden a los metales alcalinos, en tanto, los mayores valores de PI a los gases nobles.
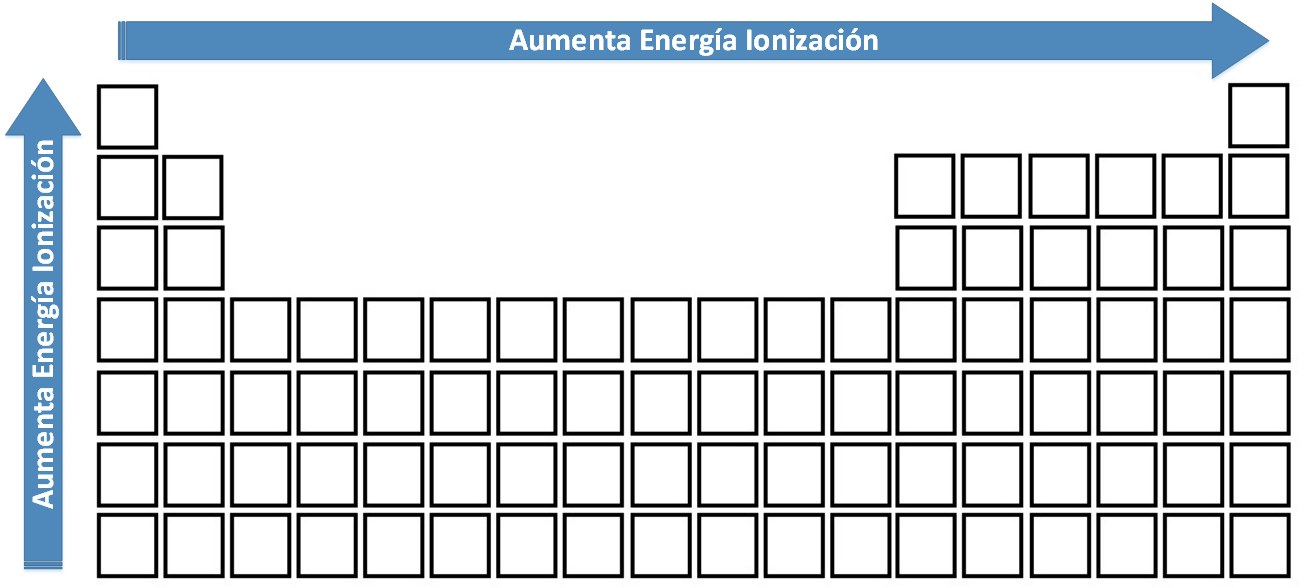
Variación de la Energía de Ionización en la Tabla Periódica.
Afinidad electrónica o Electroafinidad
Se define como una medida de la tendencia de un átomo a captar un electrón. Cuanto mayor es la afinidad electrónica de un átomo, más probable es que se convierta en un anión estable. La afinidad electrónica se determina experimentalmente y puede definirse como la energía requerida para separar un electrón de un anión gaseoso.
También está definida como la energía liberada cuando un átomo de una muestra gaseosa capta un electrón en su nivel más externo.
Consideraciones:
- Los gases inertes no tienen valor para la afinidad electrónica (poseen sus niveles completos con electrones).
- Conforme aumenta el número atómico en un período el valor de electroafinidad aumenta, esto porque aumenta el carácter no-metálico del elemento.
- Los metales del grupo I-A y II-A tienen bajos valores de electroafinidad, esto porque la tendencia de ellos es estabilizarse formando cationes (no aniones).
Variacion Periodica para la Electroafinidad
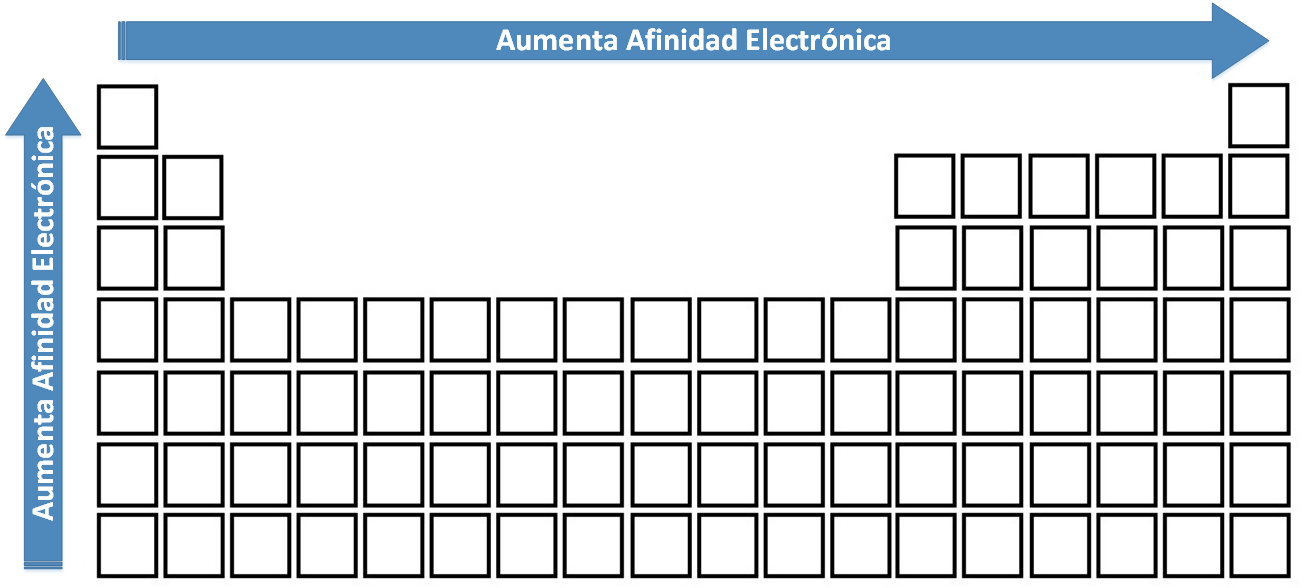
Variación de la Afinidad Electrónica en la Tabla Periódica.
Electronegatividad
La electronegatividad es la tendencia que ejerce un átomo en una molécula para atraer electrones compartidos hacia su nube o densidad electrónica. No se trata de una propiedad observable, es más bien un concepto generalizador que permite decidir hacia donde están desplazados los electrones enlazados en una molécula.
En 1930 Linus Pauling, basándose en los cálculos de energía de enlace, postuló una escala donde asignó el valor de 4,0 al flúor, el elemento más electronegativo. De acuerdo con esto, este elemento es quien tiene mayor tendencia a atraer un par electrónico enlazado hacia su nube. El valor mínimo asignado es 0,7 (cesio y francio). Estos elementos presentan menor atracción por un par electrónico enlazado.
En general:
- En un grupo conforme disminuye el valor de Z, el valor de E.N aumenta
- En un período a medida que aumenta el valor de Z, la E.N también aumenta
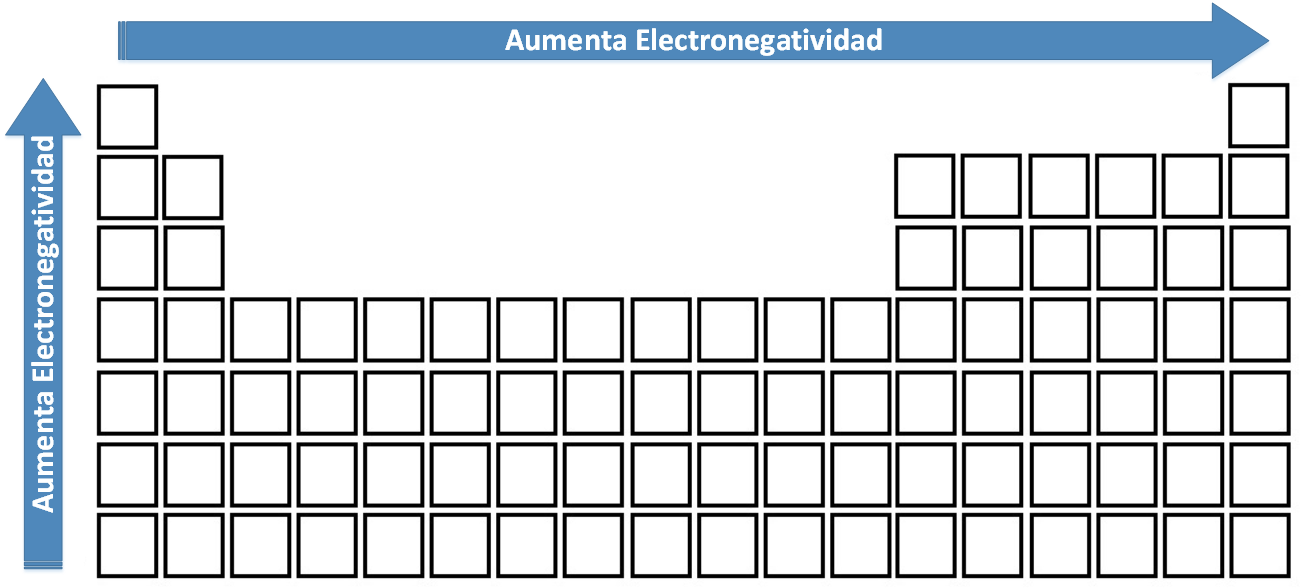
Variación de la Electronegatividad en la Tabla Periódica.
Algunos valores de Electronegatividad para elementos representativos:
| H 2,1 | ||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P2,l | S 2,5 | Cl 3,0 |
| K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
Electropositividad
Propiedad inversa a la electronegatividad. Se define como la tendencia de un elemento para ceder electrones, (puede considerarse también, como el carácter metálico de un átomo). La electropositivdad aumenta en dirección hacia los metales (en un período), y en un grupo aumenta conforme aumenta el valor de Z.
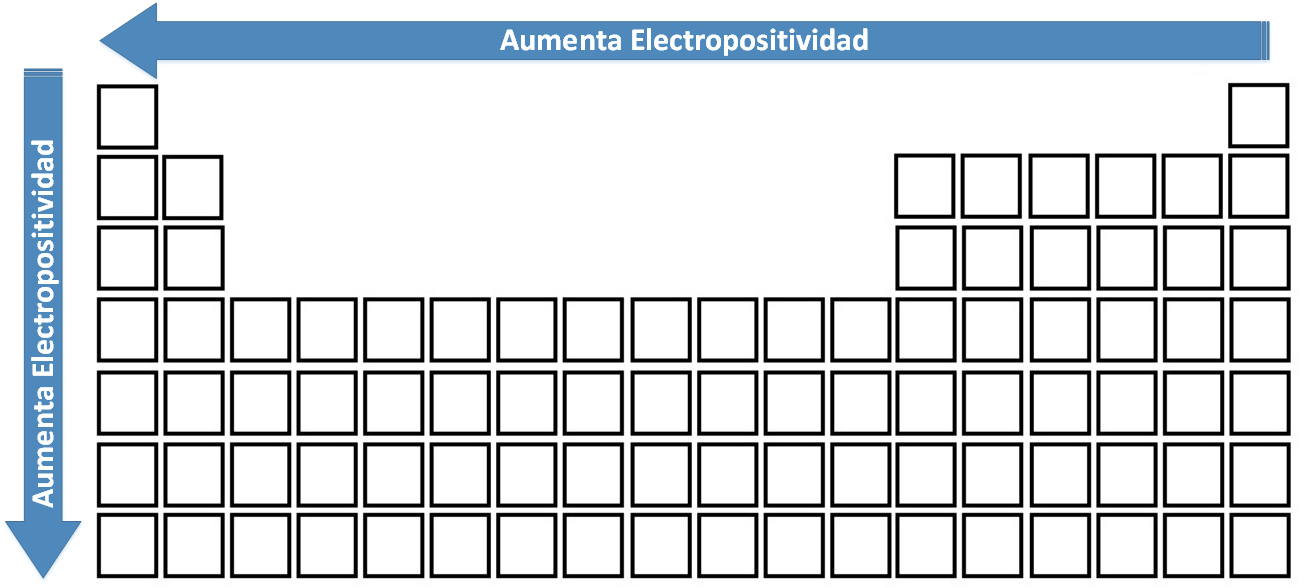
Variación de la Electropositividad en la Tabla Periódica.
Otras Propiedades Periódicas
Puntos de Fusión y Punto de Ebullición
La variación períodica de estas propiedades es irregular, pero podemos asegurar que los elementos de transición poseen puntos de fusión y ebullición más elevados que el resto de los elementos químicos, con excepción del carbono, elemento representativo cuyo punto de fusión (3800K) y ebullición (5100K) se justifica por su ordenamiento en una red cristalina. La tendencia en la variación de los puntos de fusión y ebullición se relaciona con las fuerzas de atracción entre átomos y moléculas y la masa atómica y molecular.
El punto de fusión es la temperatura a la que el elemento cambia de la fase sólida a la líquida, a la presión de 1 atm. En el Sistema Internacional se mide en K (Kelvin).
El punto de ebullición , es la temperatura a cual, la presión de vapor de un líquido iguala a la presión atmosférica.
Conforme aumenta el valor de Z aumentan las temperaturas de fusión y ebullición
Densidad
La densidad es la relación entre la masa de un átomo y el volumen que éste ocupa. Es una propiedad que depende del estado físico del elemento y la temperatura a la que se encuentre. La variación de la densidad en el sistema periódico es similar a la de los puntos de fusión y ebullición, siendo los elementos de transición quienes presentan los mayores valores.
Variación de la Densidad en la Tabla Periódica.
