Dado que la columna vertebral de los compuestos orgánicos es el carbono es conveniente repasar algunas de sus características: geometría, valencia, estado de oxidación, capacidad de enlace y formas nuevas de representar gráficamente la estructura de las moléculas. El carbono es un elemento no-metálico que pertenece al grupo IV-A del sistema periódico, por lo tanto su configuración electrónica basal viene dada por:
| Símbolo | Numero atómico (Z) | Configuración electrónica |
| C | 6 | 1s2 2s2 2p2 |
De lo anterior se infiere correctamente lo siguiente:
- Los átomos de carbono presentan 4 electrones de valencia.
- Los 4 electrones pueden actuar formando enlaces, entonces el carbono es tetravalente.
- Los átomos de carbono se pueden enlazar entre si formando cadenas.
Formulas estructurales espaciales
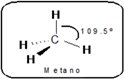 | 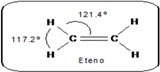 | 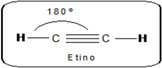 |
| carbono sp3 | carbono sp2 | carbono sp |
| Geometría tetraedrica con ángulos de enlace de 109.5° | Geometría trigonal plana donde los ángulos de enlace son de 120° aproximadamente | Geometría lineal con angular |
Tipos de carbono, clasificación respecto a su energía
Carbono Primario, Secundario, Terciario y Cuaternario
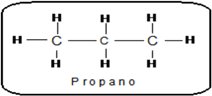 Un átomo de carbono es primario si se encuentra unido directamente solo a 1 átomo de carbono Un átomo de carbono es primario si se encuentra unido directamente solo a 1 átomo de carbonoEn el propano, los carbonos de los extremos son primarios. |
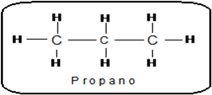 Un átomo de carbono es secundario si se encuentra unido directamente a 2 átomos de carbono. Un átomo de carbono es secundario si se encuentra unido directamente a 2 átomos de carbono.El átomo de carbono central, es secundario. |
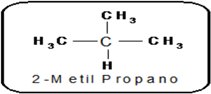 Un átomo de carbono es terciario cuando esta unido directamente a 3 átomos de carbono. Un átomo de carbono es terciario cuando esta unido directamente a 3 átomos de carbono.El carbono central de 2 metil-propano es terciario. |
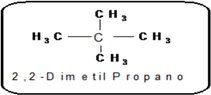 Un átomo de carbono sera cuaternario si esta unido directamente a 4 átomos de carbono. |