El intercambio electrónico que se produce en una reacción de óxido-reducción se aprovecha para establecer dispositivos que convierten en energía eléctrica la energía liberada en un proceso REDOX. Estos dispositivos se denominan pilas galvánicas o pilas electroquímicas. Una pila se establece cuando los procesos de oxidación y reducción ocurren en compartimentos separados, unidos sólo por un hilo conductor (metal).
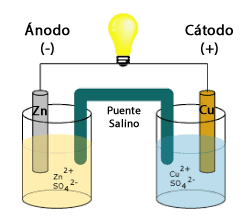
Esquema de una pila galvánica
Reacción en estudio:
![]()
Componentes de una pila galvánica
- Celda donde ocurre la semireacción de oxidación.
- Celda donde ocurre la semireacción de reducción.
- Puente salino (equipara las cargas eléctricas en ambas celdas).
- Electrodos metálicos (dispositivos en donde se transfieren electrones).
- Soluciones iónicas (medio en el que ocurre la transferencia).
- Voltímetro, dispositivo electrónico que verifica el paso de electrones en el alambre conductor.
Funcionamiento de una pila galvánica
Al conectar las placas metálicas con el hilo conductor ocurre el flujo espontáneo de electrones evidenciado por una ampolleta que se ilumina o un voltímetro que mide la diferencia de potencial de la pila (diferencia entre los electrodos).
Con el transcurso del tiempo se observa que la placa de cobre (Cu) aumenta su masa, mientras que la placa de cinc (Zn) se disuelve (pierde masa). Esta diferencia de masas en las placas se justifica por el avance de la reacción de óxido-reducción (paso de electrones).
Para evitar la acumulación de cargas en los alrededores de las láminas se sitúa entre los compartimentos un puente salino (electroneutralidad).
En las láminas metálicas (electrodos) se produce respectivamente:
Cátodo: reacción de reducción
Ánodo : reacción de oxidación
Notación de una pila galvánica
La notación de una pila implica describirla de acuerdo con las reacciones que ocurren en cada celda, entendiendo que siempre la reducción ocurrirá en el cátodo y la oxidación en el ánodo. La escritura se hace de derecha a izquierda considerando como primera reacción la oxidación e indicando por separado la especie inicial de la oxidada por una barra, luego una doble barra separa una celda de otra y se continúa con la reacción del cátodo, tal como ilustra la figura de la pila anteriormente estudiada.
