Algunos objetos muestran una propiedad denominada carga eléctrica, que puede ser positiva (+) o negativa (-). Las cargas positivas y negativas se atraen, se neutralizan entre sí, mientras que dos cargas positivas o dos negativas se repelen.
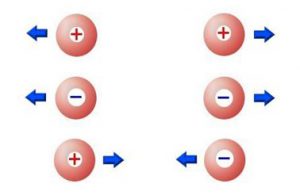
Las cargas positivas y negativas se atraen, se neutralizan entre sí, mientras que dos cargas positivas o dos negativas se repelen.
Todos los objetos materiales están formados por partículas cargadas.
- Un objeto eléctricamente neutro tiene un número igual de partículas cargadas positiva y negativamente y no lleva carga neta.
- Si el número de cargas positivas es mayor que el número de cargas negativas, el objeto tiene una carga neta positiva.
- Si el número de cargas negativas excede al de las positivas, el objeto tiene una carga neta negativa.
Se puede observar que cuando frotamos una sustancia contra otra, como cuando nos peinamos, se produce una carga eléctrica estática, lo que implica que el frotamiento separa algunas cargas positivas y negativas. Además, cuando se produce una carga positiva en algún lugar, también aparece una carga negativa equivalente en otro lugar de forma que la carga se compensa.

Peineta Cargada Eléctricamente
El descubrimiento de los Electrones
La abreviatura para los tubos de rayos catódicos, CRT, se ha convenido en un acrónimo habitual. El CRT es el corazón de los monitores de ordenador y los aparatos de televisión. El primer tubo de rayos catódicos fue construido por Michael Faraday (1791-1867) hace 150 años aproximadamente. Al hacer pasar la electricidad a través de tubos de vidrio sometidos al vacío, Faraday descubrió los rayos catódicos, un tipo de radiación emitida por el polo negativo o cátodo que atravesaba el tubo evacuado hacia el polo positivo o ánodo. Posteriormente los científicos encontraron que los rayos catódicos viajan en línea recta y tienen propiedades que son independientes del material del cátodo (es decir, de si éste es hierro, platino, etc.).
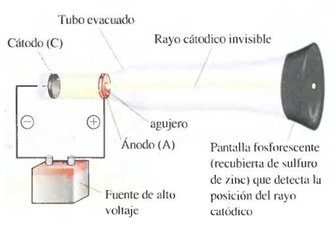
Tubo de Rayos Catódicos
Un tubo de rayos catódicos se compone de una fuente de electricidad de alto voltaje que crea una carga negativa sobre el electrodo de la izquierda (cátodo) y una carga positiva sobre el electrodo de la derecha (ánodo). Los rayos catódicos se dirigen desde el cátodo (C) hacia el ánodo (A) que está perforado para permitir el paso de un haz estrecho de rayos catódicos. Los rayos solamente son visibles mediante el color verde fluorescente que producen sobre una pantalla recubierta de sulfuro de zinc. Son invisibles en el resto del tubo.
Los rayos catódicos producidos en el CRT, son invisibles, y sólo pueden detectarse por la luz emitida por los materiales con los que chocan. Estos materiales denominados fosforescentes se utilizan como pintura al final del CRT, de manera que pueda verse el recorrido de los rayos catódicos. (Fluorescencia es el término utilizado para describir la emisión de luz por una sustancia fosforescente cuando ésta recibe radiación energética.) Otra observación importante sobre los rayos catódicos es que son desviados por los campos eléctricos y magnéticos de la forma esperada para las partículas cargadas negativamente.
Desviación de los rayos catódicos por un campo eléctrico
El haz de rayos catódicos es desviado cuando viaja de izquierda a derecha en el campo creado por las placas del condensador (E) cardadas eléctricamente. La desviación corresponde a la esperada para partículas con carga negativa.
Desviación de los rayos catódicos en un campo magnético
El haz de rayos catódicos es desviado cuando viaja de izquierda a derecha en un campo magnético (M). La desviación corresponde a la esperada para partículas con carga negativa.
En 1897, J. J. Thomson (1856 -1940) estableció la relación entre la masa (m) y la carga (e) de los rayos catódicos, es decir, masa/carga (m/e), mediante el método descrito en la Siguiente Figura. Thomson, también concluyó que los rayos catódicos son partículas fundamentales de materia, cargadas negativamente y que se encuentran en todos los átomos. (Las propiedades de los rayos catódicos son independientes de la composición del cátodo.) Posteriormente, a los rayos catódicos se les dio el nombre de electrones, término propuesto por George Stoney en 1874.
Determinación de la razón masa-carga para los rayos catódicos
El haz de rayos catódicos choca con la pantalla al final del tubo sin desviarse si las fuerzas ejercidas sobre el haz por los campos eléctrico y magnético se contrarrestan. Conociendo la intensidad del campo eléctrico y magnético, junto con otros datos, se puede obtener el valor de masa/carga. Las medidas más precisas proporcionan un valor de -5,6857 × 10-9 gramos por culombio. (Como los rayos catódicos tienen carga negativa, el signo de la relación carga-masa también es negativo.)
Robert Millikan (1868-1953), determinó la carga electrónica (e) mediante una serie de experimentos con gotas de aceite (1906-1914) descritos en la Siguiente Figura. El valor de la carga electrónica aceptado actualmente, expresado con cinco cifras significativas es:
-1,6022 × 10-19 C.
Utilizando este valor y un valor exacto de la relación masa-carga para un electrón, se obtiene que la masa de un electrón es :
9,1094 × 10-28 g.
Experimento de la gota de Millikan
Los iones, átomos o moléculas cargadas, se producen por la acción de una radiación energética conocida como rayos X. Algunos de estos iones llegan a unirse a pequeñas gotitas de aceite, proporcionándoles una carga neta. La velocidad de caída de una gotita en el campo eléctrico entre las placas del condensador aumenta o disminuye dependiendo de la magnitud y el signo de la carga de la gota. Analizando los datos de un gran número de gotitas. Millikan concluyó que la magnitud de la carga, (q) de una gota es un múltiplo entero de la carga electrónica, (e). Es decir, q = n e (donde n = 1, 2, 3,…)
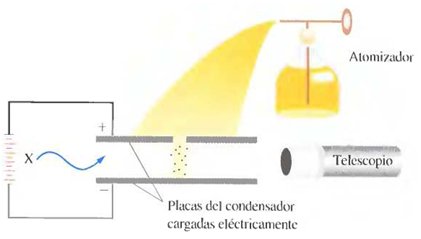
Experimento Robert Millikan
Una vez considerado el electrón como una partícula fundamental de la materia existente en todos los átomos, los físicos atómicos empezaron a especular sobre cómo estaban incorporadas estas partículas dentro de los átomos. El modelo comúnmente aceptado era el propuesto por J. J. Thompson, quien pensó que la carga positiva necesaria para contrarrestar las cargas negativas de los electrones en un átomo neutro estaba en forma de una nube difusa. Sugirió que los electrones flotaban en esta nube difusa de carga positiva, semejante a una masa de gelatina con los electrones a modo de “frutas” embebidos en ella. A este modelo se le dio el nombre de budín de ciruelas por su semejanza con un conocido postre inglés.

