Elemento Químico y Compuesto Químico
La materia está formada por unidades diminutas llamadas átomos. Un elemento químico es una sustancia formado por un solo tipo de átomos. En la naturaleza se pueden encontrar aproximadamente 90 de estos elementos. El resto no aparece de forma natural y solo se pueden obtener de forma artificial.
Los compuestos químicos son sustancias en las que se combinan entre si átomos de diferentes elementos. Existen millones de compuestos químicos diferentes. Una molécula es la entidad más pequeña posible en la que se mantiene las mismas proporciones de los átomos constituyentes que en el compuesto químico.
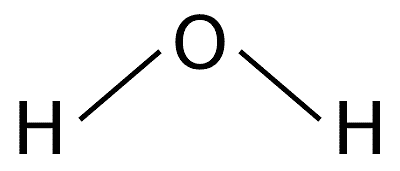
Por ejemplo: Una molécula de agua está formada por tres átomos: dos átomos de hidrógeno unidos a un solo átomo de oxígeno.
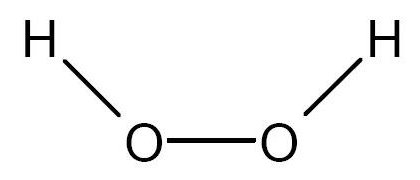
Por ejemplo: Una molécula de peróxido de hidrógeno tiene dos átomos de hidrógeno y dos átomos de oxígeno. Los átomos de oxigeno están unidos entre si y hay un átomo de hidrógeno unido a cada átomo de oxígeno.
Los elementos y compuestos se denominan sustancias.
Mezclas Homogéneas y Mezclas Heterogéneas
Una mezcla de sustancias puede variar en composición y propiedades de una muestra a otra. Cuando una mezcla es uniforme en composición y propiedades en cualquier parte de una muestra determinada se dice que es una mezcla homogénea o una disolución.

Por ejemplo: una disolución acuosa de sacarosa tiene dulzor uniforme en cualquier parte de la disolución.
En las mezclas heterogéneas, como la formada por agua y aceite. Los componentes se separan en zonas diferenciadas. Por lo tanto la composición y las propiedades físicas varían de una parte a otra de la mezcla.

Por ejemplo: una mezcla conformada por agua y aceite. Los componentes se separan en zonas diferenciadas.
Separación de Mezclas
Los componentes de una mezcla pueden separarse mediante transformaciones físicas adecuadas.

Por ejemplo: Una mezcla heterogénea de arena y agua pueden separarse utilizando un embudo provisto de un papel filtro. El agua atraviesa el medio poroso, pero la arena es retenida por el papel filtro. Este proceso se denomina filtración.

Por ejemplo: Una disolución de Sulfato de Cobre II, puede separarse mediante la destilación. Este proceso básicamente consiste en calentar la disolución, el agua líquida se obtiene en estado gaseoso al hervir la disolución, en cambio el sulfato permanece en el recipiente.
Estados de la Materia
La materia puede encontrarse en uno de los tres estados sólido, líquido, o gas.
| Solido | Liquido | Gas |
| En un sólido los átomos o moléculas están en contacto próximo. Por lo tanto tienen una forma definida. Su disposición es ordenada y generalmente poseen una forma definida. | En un líquido, los átomos o moléculas están generalmente separados por distancias mayores que en un sólido. El movimiento de estos átomos o moléculas proporciona al líquido una de sus propiedades más características: la capacidad de fluir cubriendo el fondo y adoptando la forma del recipiente que lo contiene. | En un gas, las distancias entre átomos o moléculas son mucho mayores que en un líquido. Un gas siempre se expande hasta llenar el recipiente que lo contiene. |
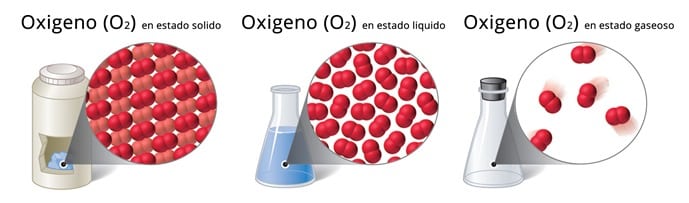
Estados de la Materia
El Oxigeno diatomico puede encontrarse en los tres estados de la materia. Como se aprecia en la figura podemos considerar un punto de vista macroscópico, el cual se refiere a cómo percibimos la materia con nuestros ojos, a través de la apariencia externa de los objetos. Y un punto de vista microscópico que describe la materia en función de los átomos y moléculas.



