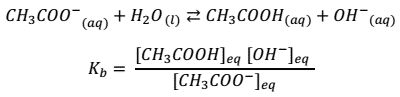Según la teoría de Brönsted y Lowry, los ácidos presentan notables diferencias en su capacidad de producir protones, y las bases en captarlos. Así, existen los ácidos y las bases fuertes y débiles.
Ácidos fuertes
Son aquellos que se disocian completamente en disolución acuosa. La mayor parte de estos ácidos son inorgánicos. Por ejemplo, el ácido clorhídrico (HCI):
![]()
En el equilibrio, gran parte de la reacción se desplaza hacia la derecha, ya que el HCI ál ser fuerte cede fácilmente su protón. La base conjugada (CI–) es una base débil por tener poca tendencia a retener el protón.
Ácidos débiles
Son aquellos que en disolución acuosa se disocia solo una pequeña fracción. Por ejemplo, el ácido cianhídrico (HCN):
![]()
Bases fuertes
Son aquellas que se disocian completamente en disolución acuosa. Por ejemplo, el hidróxido de sodio (NaOH):
![]()
Bases débiles
Son aquellas que en disolución acuosa se disocia solo una pequeña fracción. Por ejemplo, el amoníaco (NH3):
![]()
Constante de disociación
A la constante de equilibrio de los ácidos y las bases se le conoce como constante de disociación Esta se establece ya que las disoluciones ácidas y básicas se consideran sistemas en equilibrio. La constante de disociación para las disoluciones ácidas se expresa como Ka y las de las disoluciones básicas, Kb.
Si los valores de Ka, y Kb: son mayores a 1. Significa que las disoluciones presentan un alto grado de disociación. En las disoluciones de ácidos y bases fuertes, Ka, y Kb son > 1, por lo que el equilibrio se desplazará hacia la derecha. En cambio, para ácidos y bases débiles. Ka y Kb son
bajas.
Por ejemplo para la reacción del ácido acético
![]()
La constante de ionización está dada por:
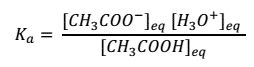
Y la constante de ionización de su base conjugada por: