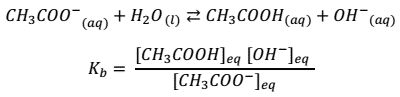Los ácidos y las bases son sustancias utilizadas desde la antigüedad. Se han encontrado papiros de la cultura helenística donde se describe la utilización de vinagres y zumos de frutas como disolventes de ciertos metales; los egipcios usaban sales, como el carbonato sódico conocido como natrón, para desecar los cuerpos en la momificación.
Siglos más tarde, con el descubrimiento de la técnica de destilación, se obtuvieron ácidos minerales lo que permitió disolver un mayor número de sustancias; sin embargo, ninguno de estos ejemplos sirvió para explicar lo que era un ácido y una base. En el siglo XVII, Boyle, basándose en observaciones y trabajos experimentales, concluyó que existe un grupo de sustancias que poseen propiedades semejantes, a las que llamó ácidos, y otras con propiedades diferentes a estas, a las que llamó bases. Luego de este planteamiento, y en un intento por explicar las propiedades observadas para las sustancias acidas y básicas y poder entender su comportamiento, científicos como Arrhenius, Brönsted, Lowry y Lewis formularon diversas teorías.
Todo este conocimiento ha permitido hoy en día una aplicación adecuada de estas sustancias. Por ejemplo, se puede explicar por qué los jabones resecan la piel, cómo se debe controlar la acidez en un acuario, cómo debe ser la acidez o basicidad del suelo para los cultivos o los daños causados por la lluvia ácida.
Ácidos y Bases
Las soluciones acuosas de los ácidos se caracterizan por:
- Tener sabor agrio.
- Conducir la corriente eléctrica, es decir, son electrolitos.
- Enrojecer determinados pigmentos vegetales, como la tintura del tornasol o decoloran el repollo morado.
- Reaccionar con algunos metales como el magnesio y el zinc liberando hidrógeno gaseoso (H2).
- Al reaccionar con bases forman sustancias de propiedades diferentes, las bases.
Las soluciones acuosas de las bases, en cambio:
- Tienen sabor amargo y son jabonosas al tacto.
- Conducen la comente eléctrica, es decir, son electrolitos.
- Al entrar en contacto con el papel tornasol se torna azul.
- Al reaccionar con ácidos forman sustancias de propiedades diferentes, las sales.
Teorías Ácido-Base
Teoría de Arrhenius
Swante Arrhenius
En 1887, Svante Arrhenius (1859-1927) postuló su teoría de la disociación electrolítica, la cual planteaba que existen sustancias que manifiestan sus propiedades químicas y su conductividad eléctrica en disoluciones acuosas. Por ejemplo: las sales, al disolverse en agua pueden descomponerse en sus iones, lo que les permite ser conductores eléctricos. A estas sustancias se les llama electrolitos.
| Teoría de la disociación electrolítica | |
|---|---|
| Ácidos | Bases |
| Sustancias que en disolución acuosa producen iones hidrógeno, también llamados protones (H+). Ecuación general :
Ejemplo : disociación del ácido clorhídrico
| Sustancias que en disolución acuosa producen iones hidroxilo (OH–). Ecuación general :
Ejemplo : disociación del hidróxido de sodio
|
Teoria de Brönsted-Lowry

Johannes Brönsted

Thomas Lowry
La teoría de Arrhenius presenta algunas complicaciones, entre ellas:
- No poder explicar el comportamiento de algunas bases, como el amoníaco, ni de ciertos iones como el ion bicarbonato.
- Limitaba las reacciones ácido-base a disoluciones acuosas y omite las reacciones que se producen en fase gaseosa.
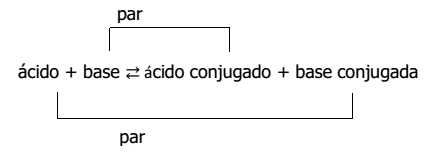
Esta razón llevó a Johannes Brönsted (1879-1947) y Thomas Lowry (1874-1936) a postular una teoría más general, la cual podía ser aplicada a todos los ácidos y bases, llamada teoría protónica. Esta postula que un ácido es toda sustancia capaz de ceder protones y una base es una sustancia capaz de captarlos. Por lo que las reacciones entre ácidos y bases se pueden considerar como reacciones de transferencia de protones.
La teoría de Brönsted y Lowry establece que los ácidos ceden protones y las bases captan protones. De acuerdo con esto:
- Los ácidos, al ceder el protón, originan una base conjugada, es decir, una especie capaz de aceptar el protón y volver a generar el ácido inicial.
- Las bases, al aceptar un protón, forman un ácido conjugado, el cual puede donar el protón, volviendo a originar la base inicial.
Así, la ecuación general para el par conjugado ácido-base será:
| Pares conjugados ácido – base | |
|---|---|
| Ácidos | Bases |
| Ejemplo : dilución de ácido fluorhídrico en agua.
| Ejemplo : disolución del amoniaco en agua.
|
Teoría de Lewis

Gilbert Lewis
Al no cumplirse la teoria de Bronsted-Lowry para todos los compuetos, Gilbert Lewis (1875-1946) propuso una nueva teoría basada en la estructura electrónica. Esta teoría plantea que:
- Un ácido es todo átomo, molécula o ion capaz de aceptar un par de electrones para formar una unión covalente.
- Una base es todo átomo, molécula o ion capaz de ceder un par de electrones para formar una unión covalente.
De este modo, un H+ será un ácido de Lewis, ya que su estructura permite aceptar un par de electrones, mientras que el amoníaco será una base de Lewis, pues en la capa de valencia del nitrógeno existe un par de electrones sin compartir.