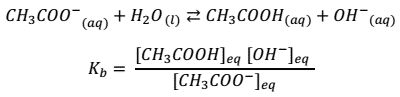Carácter anfótero del agua
El agua puede actuar tanto como ácido o como base; esto dependerá del medio en que se encuentre. Se comportará como base al reaccionar con ácidos como el ácido clorhídrico (HCl) y ácido acético (CH3COOH); y como ácido, al reaccionar con bases como el amoniaco (NH3). A los compuestos que se comportan de esta manera se les llama anfóteros.
Equilibrio iónico del agua
El agua en estado puro se autoioniza (reacción en la que existe una transferencia de protones entre moléculas de la misma clase) en una pequeña cantidad, generando iones hidronio (H3O+) e iones hidroxilo (OH–), según:
![]()
Siendo la ecuación simplificada:
![]()
De esta ecuación se puede establecer la constante de equilibrio para la ionización del agua:
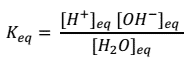
La concentración del agua [H2O] se considera constante al comparar la concentración del agua pura sin disociar con la parte ionizada, quedando:
![]()
A esta expresion se le llama producto iónico del agua (Kw). En ella, las concentraciones de los iones H+ y OH– se expresan en unidades de molaridad (mol/L). A 25 °C el valor de Kw es 1,0 x 10-14
![]()
En el agua pura, la concentración de H+ y OH– es la misma, siendo: [H+] = 1,0 x 10-7 y [OH–] = 1,0 x 10-7
![]()
Todas las disoluciones en que se cumpla que [H+] = [OH–] son neutras.
Disoluciones acidas básicas y neutras
De acuerdo a las concentraciones de [H+] y [OH–], las disoluciones pueden ser acidas, básicas o neutras.
- Una disolución ácida será aquella que tenga una mayor concentración de H+ en comparación con OH–
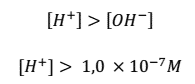
- Una disolución básica será aquella que tenga una mayor concentración de OH– en comparación con H+
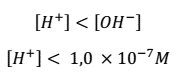
- Una disolución neutra será aquella que presente igual concentración de H+ y OH–:
![]()
A partir de la relación que se establece entre [H+] y [OH–]. Se puede conocer la concentración de cualquier ion y definir qué tipo de disolución es. Por ejemplo, si se quiere determinar [OH–] para una disolución cuya concentración de H+ es de 2,0 x 10-4 M.
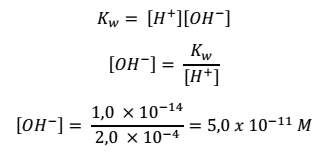
Del valor se concluye que, como [H+] > [OH–], la disolución es ácida.