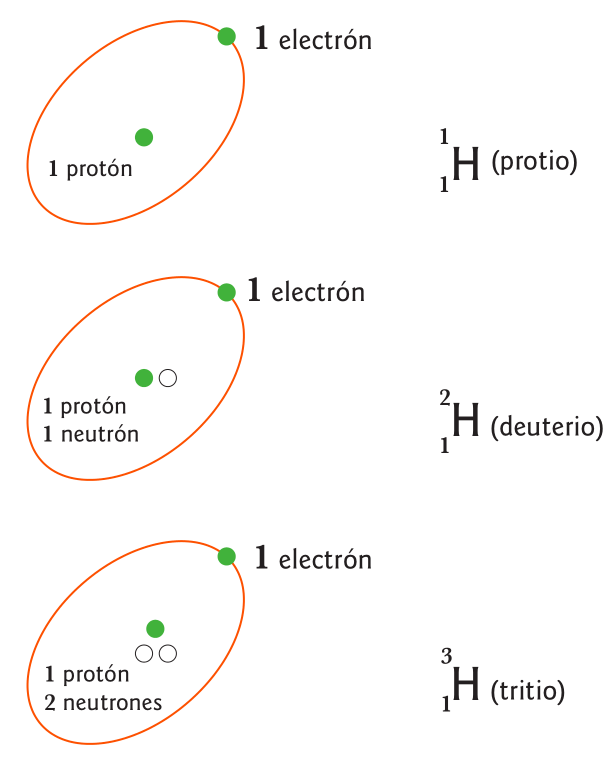
La Radiactividad fue descubierta en forma accidental en 1896 por el científico francés Antoine Henry Becquerel. Estudiando un mineral de Uranio (pechblenda), Becquerel observó fosforescencia (propiedad de ciertos materiales que les permite absorber energía y emitirla luego en forma de radiación) sin que el mineral hubiera sido expuesto previamente a la luz. Comprobó que el mineral emitía radiación capaz de marcar una placa fotográfica. Al igual que los rayos X, los rayos provenientes del mineral pechblenda eran de alta energía y fue imposible desviarlos con un campo electromagnético externo. Sin embargo, diferían de los rayos X, puesto que se emitían de manera espontánea del material de uranio.
Marie Curie y su esposo Pierre, comenzaron a estudiar el fenómeno y descubrieron que otros minerales tenían la misma propiedad que la pechblenda. Determinaron que el fenómeno era exclusivo del núcleo de los átomos. Marie Curie (discípula de Becquerel), propuso el término radiactividad para estas radiaciones espontáneas de partículas y energía. A fines de 1897 los esposos Curie descubrieron otros dos elementos radiactivos, el polonio (Po) y el radio (Ra).
En 1902 Ernest Rutherford demostró que la radiactividad generaba transformaciones espontáneas y de este modo un elemento puede transformarse en otro. En 1903 Marie, Pierre y Becquerel recibieron el Nobel de Física por el descubrimiento de la radiactividad natural. Finalmente, en 1911 Marie Curie aisló el Radio y obtuvo su masa atómica, el descubrimiento le significó un segundo premio Nobel.
Procesos de Desintegracion
Cuando un átomo presenta un núcleo inestable, puede emitir radiaciones de forma espontánea. Estas radiaciones ocurren con liberación de energía y muchas veces acompañada de partículas con masa (neutrones por ejemplo). También es posible (en los reactores nucleares) generar emisiones desde un átomo no radiactivo. En ambos, el fenómeno es exotérmico (se libera de energía) y los núcleos hijos que se generan siempre son más estables que su predecesor.
[alert-success]
Emision Espontanea ⇒ Radiactividad natural.
Emision Artificial ⇒ radiactividad artificial.
[/alert-success]
Considerando las reacciones expuestas, estas se pueden clasificar en dos tipos. Al primer tipo de emisión se le denomina radiactividad natural mientras que la emisión desde un núcleo estable no radiactivo se le conoce como radiactividad artificial.
En general se conoce 5 tipos de desintegraciones radiactivas naturales:
- Emisión de partículas alfa (α)
- Emisión de partículas beta (β)
- Emisión de rayos gamma (γ)
- Emisión de positrones (β+)
- Captura electrónica (CE)
Emisiones Alfa ( )
)
Corresponde a partículas con carga eléctrica positiva +2 y 4 unidades de masa atómica. Son núcleos de Helio con poco poder de penetración y gran capacidad ionizante. Se emiten preferentemente en núcleos con gran masa.
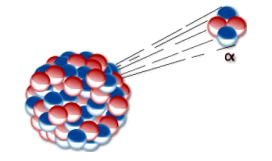
Emisión Alfa
Ecuación General:
Emisiones Beta ( )
)
Son partículas con carga eléctrica negativa (electrones) que viajan a gran velocidad. Se desvían frente a un campo electromagnético y son mucho más penetrantes que las radiaciones alfa. Las emisiones beta provienen del núcleo producto de la desintegración de un neutrón. El átomo que queda de la desintegración aumenta en 1 unidad su número atómico, pero mantiene su número de masa (debemos recordar que protón y neutrón presentan masas similares).
Junto con las partículas beta también se emiten antineutrinos (ν), que carecen de carga eléctrica y poseen una masa inferior a 4·10-5 veces la masa del electrón (energía). Cada vez que un átomo radiactivo se desintegra emitiendo una partícula beta, el núcleo hijo será isobaro del átomo que lo generó.
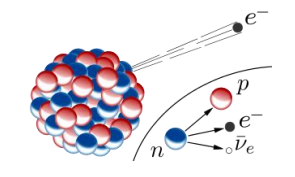
Emisiones Beta
Emisión Gamma (γ)
Corresponde a radiación (electromagnética) de alta energía sin masa ni carga eléctrica. Se conocen algunos isótopos que emiten rayos gamma de forma pura. La emisión gamma puede ocurrir cuando un radioelemento existe en dos formas distintas (isómeros nucleares), ambas con el mismo número atómico y número másico pero con diferente energía. La emisión de rayos gamma acompaña a la transición del isómero de mayor energía a la forma de menor energía. Un ejemplo de esta isomería es el isótopo protactinio 234 (Pa), que existe con 2 estados de energía diferentes, y en el que la emisión de rayos gamma indica la transición de uno al otro.
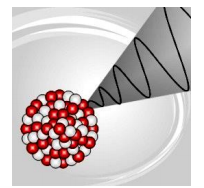
Emisión Gamma
En la emisión de rayos gamma no hay cambios en el número de protones y neutrones en el núcleo por lo tanto, no hay transmutación (cambio en el número Z de un elemento).
Emision de Positrones ( o β+)
o β+)
La emisión de positrones se produce cuando un protón del núcleo se transforma en un neutrón emitiendo una partícula denominada positrón (β+).
Cuando un positrón choca con un electrón, ambos desaparecen y se emiten dos fotones de radiación gamma en un proceso llamado aniquilación.
Captura Electrónica (CE)
Se produce captura electrónica cuando un electrón proveniente de las capas más internas del átomo cae dentro del núcleo con lo cual un protón se transforma en neutrón. Esto provoca una disminución en el número atómico, pero se mantiene constante el número de masa.
Nomenclatura estandarizada para las emisiones
| Protón |
|
|
| Neutrón |
|
|
| Emisión beta |
|
|
| Positrón |
|
|
| Partícula alfa |
|
|
Transmutación
Es el fenómeno donde un átomo se transforma en otro por cambio en el número de protones. Esta transformación puede ser natural cuando un átomo emite radiaciones, positrones o captura electrónica, o también puede producirse por medios artificiales (bombardeo de un núcleo estable con neutrones). En ambos casos el nuevo elemento puede ser también radiactivo y seguirá emitiendo hasta transformarse en otro.
Radiactividad y sus aplicaciones
Los fenómenos radiactivos se utilizan con propiedad en muchas ramas de la ciencia siendo la química, la física y la medicina, las con mayor potencial de aplicación. Los isótopos radioactivos se utilizan en la medicina nuclear, principalmente en las imágenes médicas, para estudiar el modo de acción de los medicamentos, entender el funcionamiento del cerebro, detectar una anomalía cardiaca, descubrir las metástasis cancerosas, entre otras.
En la industria: radiografías de aleaciones para detectar fallas, control de producción midiendo espesor, control en el desgaste de los materiales, estudios de detergentes, detección de filtraciones o fugas, generación de corriente eléctrica, conservación de alimentos, esterilización de instrumentos quirúrgicos.
En química: Uso de trazadores en reacciones a estudiar, análisis por activación neutrónica para determinar vestigios de impurezas (éste último muy utilizado en ciencia espacial, geología, ecología, etc.).
En la agricultura: en trazadores para estudiar como absorben los vegetales a los fertilizantes, insecticidas y otros productos, aumentar la conservación de los alimentos, obtener, por mutaciones, cereales más resistentes y productivos, estudiar mejor la alimentación de los animales, aumentando la producción de leche, huevos, etc.