Desde el siglo V a. de C. la humanidad ha escuchado hablar de átomos, como las partículas fundamentales de la materia. Sin embargo, debido a que los átomos son tan pequeños, no es posible verlos a simple vista, por esta razón, se han propuesto varios modelos y teorías acerca de cómo son estas partículas fundamentales.
El átomo a través del tiempo
Los griegos fueron quienes por primera vez se preocuparon por indagar sobre la constitución íntima de la materia, aunque desde una perspectiva puramente teórica, pues no creían en la importancia de la experimentación. Cerca del año 450 a. de C., Leucipo y su discípulo, Demócrito, propusieron que la materia estaba constituida por pequeñas partículas a las que llamaron átomos, palabra que significa indivisible. Los postulados del atomismo griego establecían que:
- Los átomos son sólidos.
- Entre los átomos sólo existe el vacío.
- Los átomos son indivisibles y eternos.
- Los átomos de diferentes cuerpos difieren entre sí por su forma, tamaño y distribución espacial.
- Las propiedades de la materia varían según el tipo de átomos y como estén agrupados.

Demócrito es considerado como uno de los padres del atomismo.
Teoría atómica de Dalton

John Dalton, retomando las ideas de los atomistas griegos propuso la primera teoría atómica dentro del marco de la química moderna.
En 1805 el inglés John Dalton (1766-1844), publicó la obra Nuevo sistema de la filosofía química, en la cual rescataba las ideas propuestas por Demócrito y Leucipo dos mil años atrás. La razón que impulsó a Dalton a proponer una nueva teoría atómica fue la búsqueda de una explicación a las leyes químicas que se habían deducido empíricamente hasta el momento, como la ley de la conservación y la ley de las proporciones definidas.
La teoría atómica de Dalton comprendía los siguientes postulados:
- La materia esta constituida por átomos, partículas indivisibles e indestructibles.
- Los átomos que componen una sustancia elemental son semejantes entre sí, en cuanto a masa, tamaño y cualquier otra característica, y difieren de aquellos que componen otros elementos.
- Los átomos se combinan para formar entidades compuestas. En esta combinación los átomos de cada uno de los elementos involucrados están presentes siguiendo proporciones definidas y enteras. Así mismo, dos o más elementos pueden unirse en diferentes proporciones para formar diferentes compuestos.
Modelo atómico de Thomson
Antecedentes
Naturaleza eléctrica de la materia
Desde tiempos remotos habían sido observados fenómenos eléctricos relacionados con la materia. Tales de Mileto observó que al frotar un trozo de ámbar, este podía atraer pequeñas partículas. Siglos después Gilbert comprobó que por frotamiento muchas sustancias adquirían electricidad. Sin embargo, fue solo hacia mediados del siglo XIX que estas observaciones fueron planteadas formalmente, gracias a los experimentos sobre la electrólisis que realizó Faraday, hacia 1833 y que le permitieron descubrir la relación entre electricidad y materia.
Descubrimiento del electrón
El descubrimiento del electrón fue posible gracias a una serie de experimentos alrededor de un dispositivo llamado tubo de rayos catódicos, que consiste en un tubo de vidrio provisto de dos electrodos, herméticamente soldados en los extremos de este y a través de los cuales se hace pasar una corriente eléctrica. En 1879, el físico inglés William Crookes, observó que si se creaba vacío dentro del tubo, retirando el aire presente en su interior, aparecía un resplandor, originado en el electrodo negativo o cátodo y que se dirigía hacia el electrodo positivo o ánodo, por lo que Crookes concluyó que debía tratarse de haces cargados negativamente, que luego fueron bautizados como rayos catódicos. Posteriormente, J. Thomson estableció, en 1895, que dichos rayos eran en realidad partículas, mucho más pequeñas que el átomo de hidrógeno y con carga negativa, que recibieron el nombre de electrones. En la actualidad se ha establecido que la carga de un electrón es —1,602 • 10 19 culombios y que posee una masa de 9,11 • 10 28 g.
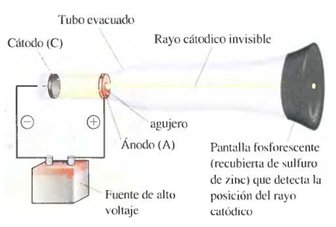
En el diseño que se muestra en la figura, se ha colocado un objeto en la trayectoria de los rayos catódicos. Este objeto produce sombra, lo que sirvió para comprobar el carácter material y particulado de los electrones.
Descubrimiento del protón
Por la misma época, Eugen Goldstein (1850-1930), realizó algunas modificaciones al diseño inicial del tubo de rayos catódicos. El nuevo dispositivo tenía el cátodo perforado y el tubo, en lugar de vacío, contenía diferentes gases. Observó que detrás del cátodo se producía otro tipo de resplandor, proveniente del ánodo, por lo que dedujo que los nuevos rayos poseían carga positiva. Posteriormente fueron bautizados como protones y se determinó que su carga era de igual magnitud que la de un electrón, es decir, +1,602 • 10 19 culombios, mientras que su masa tenía un valor cercano a 1,673 • 10 24 g.
Estos descubrimientos contradecían la creencia de que el átomo era indivisible, por lo que fue necesario concebir un nuevo modelo atómico.
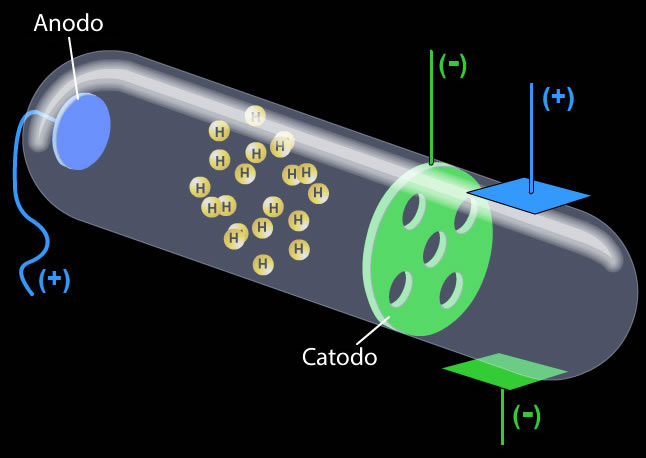
Tubo de rayos catódicos modifi cado por Golstein.
El nuevo modelo
En 1904, Joseph Thomson (1856-1940) propuso un modelo en el cual la parte positiva del átomo se hallaba distribuida uniformemente por todo el volumen de este, mientras los electrones se hallaban inmersos en esta matriz de protones, como las pasas en un pudín. Además, planteaba que la cantidad de cargas positivas y negativas presentes eran iguales, con lo cual el átomo era esencialmente una entidad neutra.
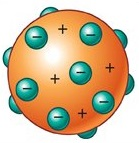
Modelo atómico de Thomson.
Modelo de Rutherford
Antecedentes
Descubrimiento de la radiactividad
La primera evidencia de este fenómeno data de 1896 y la debemos a las experiencias de Henri Becquerel (1852-1908). Este científico descubrió que los minerales de uranio eran capaces de velar una placa fotográfica en ausencia de luz externa, por lo cual concluyó que poseían la propiedad de emitir radiaciones de forma espontánea.
Posteriormente, los esposos Pierre (1859-1906) y Marie Curie (1867-1934), retomaron las observaciones hechas por Becquerel, comprobando que todos los minerales de uranio tenían la capacidad de emitir radiaciones. Además aislaron otros dos elementos con idénticas propiedades: el polonio y el radio.
La radiactividad se define como la propiedad que poseen los átomos de algunos elementos de emitir radiaciones. Debido a que las radiaciones son partículas subatómicas, los elementos radiactivos se transforman en otros elementos, pues la constitución íntima de sus átomos cambia.
Estas radiaciones pueden ser de cuatro tipos distintos:
- Rayos alfa (α): son partículas formadas por dos protones y dos neutrones, por lo que poseen una carga positiva, igual a dos veces la carga de un protón. Debido a que la masa y el volumen de las partículas alfa son relativamente elevados, estas radiaciones viajan a una velocidad baja, y tienen un poder de penetración igualmente bajo.
- Rayos beta –(β–): se trata de haces de electrones, 7.000 veces más pequeños que las partículas alfa y que viajan a una velocidad cercana a la de la luz, por lo que poseen un poder de penetración medio.
- Rayos beta +(β+): son haces de partículas similares a los electrones, pero con carga positiva, denominadas positrones. Tienen las mismas propiedades que las partículas [1 , en cuanto a masa, velocidad y capacidad de penetración. Dado que son antagonistas de los electrones, cuando un electrón y un positrón se chocan, se aniquilan mutuamente, convirtiéndose en energía electromagnética.
- Rayos gamma (γ): estos rayos son radiaciones electromagnéticas, con un contenido energético muy superior al de la luz visible, por lo que no poseen masa y tienen una gran capacidad de penetración.
Descubrimiento de los rayos X
A fines del siglo XIX, en 1895, Wilhelm Roentgen (1845 – 1923), estudiando los rayos catódicos, observó que una lámina recubierta con ciano-platinato de bario, que estaba a cierta distancia del tubo, emitía una fluorescencia verdosa. Afirmó que dicha fluorescencia correspondía a unos rayos que atravesaban los materiales poco densos, como la madera, pero que no pasaba a través de los más densos, como los metales. Además, no sufrían desviación por campos eléctricos o magnéticos. Por esta razón, concluyó que estos rayos no deberían estar formados por partículas cargadas y en esto se parecían a los rayos de luz. Roentgen los llamó rayos X.
Los dos descubrimientos mencionados dejaban entrever que había espacio entre los átomos que conformaban los materiales conocidos, pero no estaba claro cómo ni dónde se distribuían estos espacios.
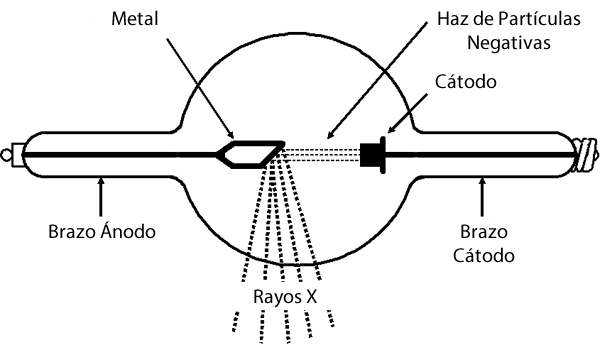
Los rayos X se generan en el interior de un tubo de descarga, cuando colisiona un haz de rayos catódicos con un blanco metálico (trozo de metal) dispuesto entre ambos electrodos. Los electrones provenientes del rayo catódico inciden sobre el metal, excitando sus propios electrones, generando una radiación de frenado de alta frecuencia denominada rayo X.
El modelo: proposición de la existencia del núcleo
A principios del siglo XX, Ernest Rutherford (1871-1937) realizó un experimento cuyos resultados fueron inquietantes. Observó que cuando un haz de partículas alfa, emitidas por el polonio, uno de los elementos radiactivos, golpeaba contra una lámina de oro, algunas de las partículas incidentes rebotaban, hasta el punto de invertir completamente la dirección de su trayectoria. Esto era tan increíble como si al disparar una bala contra una hoja de papel, ésta rebotara.
Con el fin de dar una explicación a este hecho, Rutherford propuso, en 1911, la existencia del núcleo atómico, como una zona central densa, en la cual se concentraba cerca del 99,95% de la masa atómica. El núcleo debía ser positivo, puesto que las partículas alfa, también positivas, eran rechazadas al chocar contra los núcleos de los átomos del metal. También estableció que los electrones debían mantenerse en constante movimiento en torno al núcleo, aunque a una cierta distancia, con lo cual gran parte del volumen del átomo sería espacio vacío. Al igual que Thomson, Rutherford consideró que la carga negativa de los electrones debía contrarrestar la carga positiva del núcleo, para dar lugar a un átomo neutro.
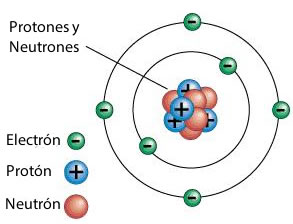
Modelo atómico de Rutherford, en el cual los electrones giran alrededor del núcleo del átomo.
Inconsistencias del modelo
Si bien, numerosos fueron los descubrimientos y fenómenos observados que permitieron comprobar la existencia del núcleo atómico y dilucidar su constitución, el modelo propuesto por Rutherford tenía ciertas inconsistencias. De acuerdo con la física clásica, toda partícula acelerada, como es el caso de un electrón girando alrededor del núcleo de un átomo, emite energía, en la forma de radiaciones electromagnéticas. En consecuencia, el electrón debería perder energía continuamente, hasta terminar precipitándose sobre el núcleo, dando lugar a un colapso atómico. Teniendo en cuenta que esto no sucede, algo estaba fallando en el modelo propuesto por Rutherford.
Descubrimiento del neutrón
Desde 1920, Rutherford había supuesto la existencia de una tercera partícula subatómica, que debía ser neutra, pues muchos elementos poseían una masa superior a lo esperado si sus núcleos solo estuvieran conformados por protones. Sin embargo, se tuvo que esperar hasta 1932 para comprobar experimentalmente la existencia de estas partículas.
El descubrimiento se atribuye a James Chadwick, quien observó que al bombardear placas de berilio con partículas alfa, estas placas emitían unas partículas, que a su vez se hacían chocar contra un bloque de parafina, ocasionando un desprendimiento de protones en este. Este hecho hacía pensar que su masa debía ser similar a la de los protones. Además, estas partículas no se desviaban por la presencia de campos eléctricos, luego debían ser neutras, por lo que se las llamó neutrones.
Actualmente se calcula que la masa de un neutrón es 1,675 • 10 –24 gramos.
Estos descubrimientos llevaron a describir al átomo como la unidad estructural de la materia, formada por tres subpartículas básicas: protones, neutrones y electrones.
Otras partículas subatómicas
Con el descubrimiento del neutrón se pensó que la estructura de los átomos había sido dilucidada en su mayor parte. Sin embargo, la historia apenas comenzaba. En 1932, Cari David Anderson (1905-1991) descubrió el positrón, con lo cual abrió las puertas a todo un panorama de nuevas partículas (más de 200 diferentes), que si bien forman parte de la materia ordinaria, se producen y desaparecen durante algunas reacciones que tienen lugar en condiciones muy especiales, obtenidas en laboratorios especializados y frecuentemente con una vida efímera.
En la tabla, que se muestra a continuación, se resumen algunas de las propiedades de las tres partículas subatómicas principales.
| Partícula | Símbolo | Carga (C) | Carga neta o relativa | Masa (g) | Masa relativa a la masa de un e– |
| Electrón | e– | -1,602 • 10-19 | -1 | 9,1095 • 10-28 | 1 |
| Protón | P | +1,602 • 10-19 | + 1 | 1,6725 • 10–4 | 1,836 |
| Neutrón | n | Neutra | 0 | 1,6749 • 10-24 | 1,838 |
Modelo planetario de Bohr

Niels Bohr es uno de los hombres que más ha aportado a la comprensión de la estructura atómica.
Con el fin de dar solución a las incosistencias que presentaba el modelo atómico de Rutherford, el físico danés Nieis Bohr propuso, en 1913, que los electrones deberían moverse alrededor del núcleo a gran velocidad y siguiendo órbitas bien definidas. Las implicaciones de este modelo se detallarán más adelante, cuando veamos el modelo atómico aceptado en la actualidad.

Modelo planetario de Bohr. Imagina las implicaciones que pudo tener para el mundo científico el descubrir que al igual que nuestro sistema solar, el interior del átomo estaba organizado en órbitas alrededor de un centro, el núcleo atómico.
Algunas propiedades de los átomos
Hemos visto hasta ahora que el átomo se compone de tres partículas subatómicas: el protón, el electrón y el neutrón. Protones y neutrones se disponen en la región central dando lugar al núcleo del átomo, mientras que los electrones giran alrededor de este centro en regiones bien definidas. Muchas de las propiedades físicas de los átomos, como masa, densidad o capacidad radiactiva se relacionan con el núcleo. Por el contrario, del arreglo de los electrones en la periferia del átomo dependen propiedades químicas, como la capacidad para formar compuestos con átomos de otros elementos. Así mismo, algunas propiedades físicas de los elementos y compuestos, como el punto de fusión y de ebullición, el color o la dureza, están determinadas en gran parte por la cubierta externa de electrones
Al describir un elemento químico se mencionan algunas de sus propiedades, entre las que se encuentra el número atómico, el número de masa y la masa atómica. A continuación explicaremos cada una de estas magnitudes.
Número atómico (Z)
El número atómico indica el número de protones presentes en el núcleo y se representan con la letra Z. Dado que la carga de un átomo es nula, el número de protones debe ser igual al número de electrones, por lo que Z también indica cuántos electrones posee un átomo. Por ejemplo, el átomo de hidrógeno, el más sencillo que se conoce, tiene un núcleo compuesto por un protón que es neutralizado por un electrón orbitando alrededor. De esta manera su número atómico es Z = 1. Debido a que el número atómico se puede determinar experimentalmente, es posible determinar si una sustancia dada es o no un elemento puro, pues en un elemento todos los átomos deben tener el mismo número atómico.
Número de masa (A)
El número de masa o número másico se representa con la letra A y hace referencia al número de protones y neutrones presentes en el núcleo.
La masa del átomo está concentrada en el núcleo y corresponde a la suma de la masa de los protones y los neutrones presentes, dado que la masa de los electrones es despreciable en relación con la masa nuclear, el número másico también es un indicador indirecto de la masa atómica.
Consideremos el siguiente ejemplo: el elemento sodio contiene 11 protones y 12 neutrones en su núcleo. Esto significa que Z es igual a 11 y A es igual a 23, es decir, la suma de 11 protones y 12 neutrones. El número de neutrones presente suele representarse con la letra N.
Z = 11; N = 12
A = N + Z, es decir, A = 12 + 11 = 23
Isótopos
Son átomos de un mismo elemento, cuyos núcleos tienen el mismo número de protones (número atómico Z), pero difieren en el número de neutrones (número de masa A). Muchos elementos presentan isótopos, por ejemplo el oxígeno en estado natural es una mezcla de isótopos, en la cual, el 99,8% corresponde a átomos con A = 16 (Z = 8 y N = 8), el 0,037% poseen A = 17 (Z = 8 y N = 9) y el 0,204% esta representado por átomos con A = 18 (Z = 8 y N = 10). Esta situación se representa escribiendo el símbolo del elemento y colocando al lado izquierdo, el número de masa (A) del isótopo como un supraíndice y el número atómico (Z) como un subíndice. Veamos algunos ejemplos:
Átomo de oxígeno (16, 17 y 18)
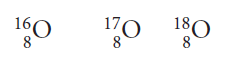
Átomo de carbono (12, 13 y 14)
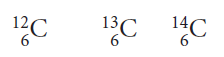
_files/Quedmica Santillana 10 (1)-110.jpg)
Isóbaros
Existen átomos de elementos diferentes, con características propias, que poseen isótopos con el mismo número de masa (A). A estos elementos se les da el nombre de isóbaros y son comunes en elementos radiactivos.
Como ejemplos podemos nombrar: calcio y argón, hierro y cobalto, estaño y telurio.
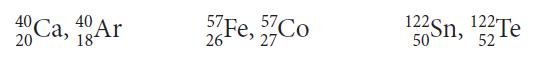
Masa atómica
Si bien la masa de un átomo no puede ser registrada por las balanzas más sensibles, esta magnitud ha sido calculada en valores cercanos a los 10-24 gramos. Por ejemplo, la masa de un átomo de hidrógeno es 1,67 • 10-24 g. Sin embargo, para facilitar los cálculos relativos a las masas atómicas de la gran variedad de elementos químicos conocidos, se ha ideado un sistema de masas relativas, en el cual, la masa de un elemento dado se calcula comparándola con la masa de otro, que se toma, arbitrariamente, como unidad patrón.
Hasta 1962, el oxígeno se empleó como patrón. Así, al átomo de oxígeno se le asignó una masa de 16 unidades de masa atómica (abreviado como u.m.a.), con lo cual una u.m.a. equivalía a 1/16 de la masa del átomo de oxígeno. Más tarde, la unidad patrón fue remplazada por el átomo de carbono, cuya masa es exactamente 12 u.m.a. Esta es la unidad patrón que se emplea en la actualidad, de manera que una u.m.a. es igual a 1/12 de la masa del átomo de carbono 12. De acuerdo con esta escala, el oxígeno tiene una masa de 15,99 u.m.a., mientras que el hidrógeno pesa 1,007 u.m.a.
Debido a la existencia de isótopos, la masa atómica de un elemento cualquiera es el promedio de la masa relativa de cada uno de sus formas isotópicas.
Ahora bien, si tomamos una cantidad en gramos, igual a la masa atómica de un elemento, expresada en u.m.a., obtenemos una nueva magnitud, denominada átomo-gramo. Así, un átomo-gramo de oxígeno equivale a 15,99 g.
Masa molecular
La masa molecular corresponde a la masa de una molécula, que es igual a la suma de las masas atómicas promedio de los átomos que la constituyen. Para calcular la masa molecular es necesario saber qué elementos forman el compuesto, su masa atómica y el número de átomos presentes en la molécula. La fórmula química nos indica qué elementos forman el compuesto y su número.
Calcular la masa atómica promedio del bromo, teniendo en cuenta los porcentajes de abundancia de sus dos isótopos.
El bromo presenta dos isótopos en la naturaleza cuyos masas atómicas y porcentajes de abundancia son respectivamente:
| Isótopo | Masa atómica | % de abundancia |
| Br-79 | 78,9183 | 50,44 |
| Br-81 | 80,9163 | 49,46 |
De donde, la masa atómica promedio es:
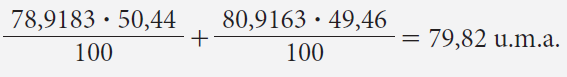
Calcular la masa molecular del ácido sulfúrico si su fórmula es H2SO4.
| Elemento | Masa atómica | No. átomos | Total |
| H | 1 | 2 | 2 |
| S | 32 | 1 | 32 |
| O | 16 | 4 | 64 |
H: 1 • 2 = 2
S: 32 • 1 = 32
O: 16 • 4 = 64
Luego, 2 + 32 + 64 = 98.
La masa molecular del ácido es 98 u.m.a.
Número de Avogadro: concepto de mol
Cuando tomamos una pequeña cantidad de algún compuesto y la pesamos en una balanza corriente, estamos manipulando un número enorme de átomos individuales, debido a que el peso en gramos de un átomo es sumamente pequeño. Para evitar el problema de hacer cálculos a partir de números muy grandes o muy pequeños, se emplea una unidad, llamada mol.
Un mol se define como la cantidad de sustancia que contiene 6,023 • 1023 partículas, ya sea de un elemento o de un compuesto. En un elemento esta cantidad es equivalente a la masa atómica expresada como gramos. Por ejemplo, en 15,99 gramos de oxígeno hay exactamente 6,02 • 1023 átomos de oxígeno. A este número se le conoce como número de Avogadro, pues fue el químico italiano Amadeo Avogadro (17761856) quien estableció esta regla. Avogadro descubrió que volúmenes iguales de diferentes gases, bajo las mismas condiciones de temperatura y presión, contenían igual número de moléculas.
Si una misma cantidad de átomos de dos elementos diferentes, tiene masas diferentes, podemos establecer qué tan pesado es uno con relación al otro. Así, si un mol de oxígeno pesa 16 g, mientras que un mol de carbono pesa 12 g, podemos concluir fácilmente que los átomos de oxígeno son más pesados que los de carbono.
El número de Avogadro es un concepto muy importante y de gran utilidad en química. Por ejemplo, sirve para calcular la masa relativa de un átomo de cualquier elemento y el número de átomos o partículas presentes en una masa determinada de una sustancia dada.
1 mol contiene 6,02 X 1023 partículas, átomos o moléculas cuya masa es igual a la masa del elemento o del compuesto.
¿Cuál es el peso en gramos de un átomo de calcio? (1 átomo de calcio tiene una masa de 40 u.m.a.) 6,02 • 1023 átomos de calcio tienen una masa equivalente a 40 g.
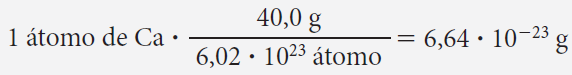
¿Cuántos átomos-gramo hay en 64,128 g de azufre, teniendo en cuenta que 1 átomo-gramo de este elemento pesa 64,128 g?
Empleando una regla de tres simple tenemos que:
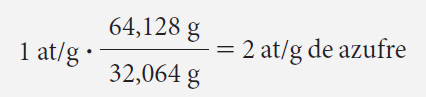
Sabiendo que el peso atómico del hidrógeno es 1,008 u.m.a., deducimos que un átomo-gramo de H pesa 1,008 g. ¿Cuántos gramos pesa un solo átomo de hidrógeno?
Si en 1,008 g hay 6,023 x 1023 átomos, un átomo individual pesará:
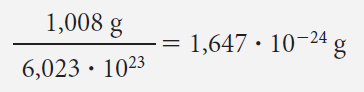
Modelo atómico actual
En las primeras décadas del siglo XX, continuaba siendo un interrogante la forma como se organizaban los electrones alrededor del núcleo atómico. La respuesta a este interrogante provino de un campo al parecer sin relación con el átomo: la espectroscopia, rama de la ciencia que estudia la emisión y absorción de energía, en forma de luz, por parte de la materia. Veamos.
Antecedentes
La naturaleza de la luz: dualidad onda-partícula
En 1865, Maxwell estableció que la luz era una onda electromagnética de alta energía y que podía propagarse en el vacío.
La naturaleza ondulatoria de la luz fue comprobada luego por numerosas observaciones y sirvió para explicar gran variedad de fenómenos, en los que los haces de luz se reflejaban o se refractaban, como si fueran ondas. Por ejemplo, la descomposición de un haz de luz blanca al pasar a través de un prisma, podía explicarse como el resultado de la refracción de la luz al cambiar de medio.

Cuando la luz blanca atraviesa un prisma, se descompone en una gama de colores.
A finales del siglo XIX un buen número de fenómenos no encajaban bien con este modelo. Uno de ellos era el efecto fotoeléctrico, según el cual una placa metálica al ser sometida a la incidencia de la luz, emitía energía en forma de electrones, que de algún modo eran arrancados de los átomos del metal. De acuerdo con la naturaleza ondulatoria de la luz, estos electrones serían estimulados por la luz incidente y sólo se desprenderían de sus átomos al recibir una cantidad de energía suficiente, es decir, con cierto retraso con relación al momento de la incidencia del haz de luz. Sin embargo, lo que se observaba era que los electrones se desprendían inmediatamente después de ser estimulados por la luz.
Por otro lado, dependiendo del color de la luz empleada, el fenómeno se producía o no, de manera que la expulsión de electrones debía estar relacionada con la longitud de onda de la luz incidente. Todo esto dejaba entrever que la luz podía comportarse también como una partícula. No obstante, hubo que esperar algunas décadas para que esta idea fuera planteada formalmente y aceptada por la comunidad científica.
El espectro electromagnético
La luz, dada su naturaleza ondulatoria, puede presentar diferentes frecuencias (ν, en nm -1 o Hz) y longitudes de onda (λ, en Å), que se ordenan en el llamado espectro electromagnético.
La cantidad de energía que transporta una onda electromagnética es función de la frecuencia, la longitud de onda y la velocidad con que viaje, según la siguiente ecuación:
![]()
donde c es la velocidad de propagación de la luz en el vacío, 300.000 km/s, λ es la longitud de onda y ν es la frecuencia. Así, a mayor frecuencia, menor será la longitud de onda y viceversa . Las ondas de alta frecuencia son las más energéticas, como los rayos gamma o los rayos ultravioleta. Por el contrario, las ondas de radio o las microondas tienen relativamente poca energía. Dentro del espectro visible, que es solo una parte muy pequeña de éste, la luz roja tiene menos energía que la azul.
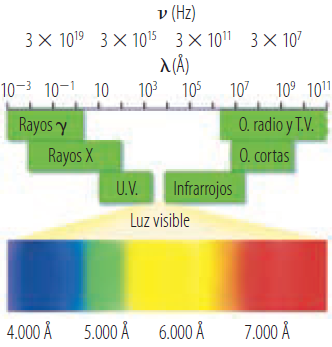
El espectro electromagnético. Observa que solo una pequeña parte del espectro es visible para el ojo humano.
Resulta que cuando un elemento cualquiera es calentado hasta la incandescencia, emite luz de un color característico, que se denomina radiación electromagnética. Si esta radiación se hace pasar a través de un prisma, lo cual se logra en un aparato llamado espectroscopio, se obtiene un conjunto de haces luminosos de diferentes colores, que conforman el denominado espectro de emisión.
El espectro de emisión es característico para cada elemento químico, como si se tratara de su huella digital. A diferencia del espectro de la luz blanca, que es continuo, tal como se observa en el arco iris, los espectros de los elementos son discontinuos, están formados por una serie de líneas.
De la misma manera como es posible registrar el espectro de emisión de un elemento, es posible también obtener el espectro de absorción, consistente en los haces de luz que no son absorbidos luego que un rayo de luz blanca atraviesa una masa del elemento en cuestión.
Los espectros de absorción y de emisión son imágenes inversas, en las que los colores que aparecen en uno, no están presentes en el otro.
Para sintetizar, el espectro de un elemento es el registro de las radiaciones absorbidas o emitidas por los átomos que lo componen.
El análisis de los espectros generados por diferentes elementos ha sido de gran utilidad para comprender el arreglo de los electrones alrededor del núcleo; adicionalmente permite identificar los distintos elementos que hay en una muestra aunque sólo existan trazas de los mismos.
Teoría cuántica de Plack
El estudio de los espectros de emisión y absorción de diferentes sustancias y cuerpos, llevó al siguiente dilema: ¿Qué pasaría con un cuerpo capaz de absorber todas las longitudes de onda de la luz incidente sobre él? Sería un cuerpo negro, pues no reflejaría luz de ningún color.
Ahora bien, este cuerpo negro debería por lo tanto emitir luz de todas las longitudes de onda presentes en el espectro electromagnético. Dado que la región ultravioleta del espectro es la más extensa, la radiación de un cuerpo negro debería ser principalmente violeta, produciendo lo que se llamó una “catástrofe ultravioleta”. Los cuerpos negros no se conocen en la naturaleza, por lo que la única manera de resolver el misterio era construir un aparato que se comportara como un cuerpo negro y observar cómo lo hacía. Este aparato consistía en una cámara de hierro cuyas paredes internas eran rugosas y estaba provista de un pequeño agujero, de manera que la luz que entraba en la cámara era completamente absorbida, y debería ser emitida nuevamente al exterior, produciendo una catástrofe ultravioleta. Esto no ocurrió así. Por el contrario, la mayor cantidad de radiaciones pertenecían a regiones cercanas al infrarrojo.

Max Planck (1858-1947).
Para resolver el conflicto el físico alemán Max Planck (1858-1947) propuso, en 1900, que la radiación emitida o absorbida por los cuerpos calientes no se presentaba de manera continua, sino en forma de cantidades discretas de energía, a las que llamó cuantos. El tamaño de un cuanto sería directamente proporcional a la frecuencia de la radiación emitida o absorbida y la magnitud de energía intercambiada debería ser un múltiplo de esta unidad.
Planck resumió estos postulados en la siguiente expresión: E = h • v, donde E es la energía, v es la frecuencia y h es una constante, la constante de Planck, con un valor de 6,6 • 10 -27 ergios • s (6,6 • 10 -34 julios • s).
Albert Einstein, en 1905, utilizó la teoría cuántica de Planck para explicar el efecto fotoeléctrico. Einstein sugirió que la luz estaba formada por paquetes de energía, que denominó fotones, cada uno de los cuales poseía una energía igual a hn, de donde se deduce que la luz de alta frecuencia, como el color azul o la radiación ultravioleta, tiene fotones más energéticos que aquella de baja frecuencia, como las ondas de radio o el color rojo. Como la energía necesaria para remover los electrones en la superficie del metal es suministrada por la luz incidente, Einstein consideró el efecto fotoeléctrico como el choque de dos partículas: un fotón y un electrón, en el cual, un electrón sólo sería expulsado por un fotón suficientemente grande. Esto explicaba por qué la expulsión de electrones ocurría instantáneamente y sólo con haces de luz de ciertos colores.
Solo había un problema: la luz debería comportarse al mismo tiempo como una onda y como una partícula. Actualmente, el carácter dual de la luz ha sido aceptado como una hipótesis de trabajo que sirve para dar explicaciones a un cierto número de observaciones, de otro modo inexplicables.
El modelo de Bohr
En 1913, el físico danés Niels Bohr (1885-1962), basándose en la teoría cuántica de Planck y en el análisis del espectro de emisión del hidrógeno, propuso un nuevo modelo atómico. En él, mantenía la estructura planetaria propuesta por Rutherford, pero hacía las siguientes precisiones acerca de la disposición de los electrones alrededor del núcleo:
- Los átomos presentan un cierto número de órbitas posibles, denominadas estados estacionarios, en las que un electrón puede girar sin que ocurra emisión o absorción de energía. En este estado, el átomo es estable.
- Cuando un átomo absorbe o emite energía en forma de radiación, los electrones a su alrededor son promovidos de una órbita a otra. Si un electrón absorbe energía, pasa a una órbita mayor, alejándose del núcleo. Al emitir luego esta energía, desciende a un estado menor, más cerca del núcleo. La cantidad de energía necesaria para pasar de un nivel a otro está cuantizada, según la ecuación propuesta por Planck. De esta manera, el colapso atómico que se desprendía del modelo de Rutherford no era posible bajo estos nuevos supuestos, pues, un electrón no puede descender más allá de un nivel de energía mínimo.
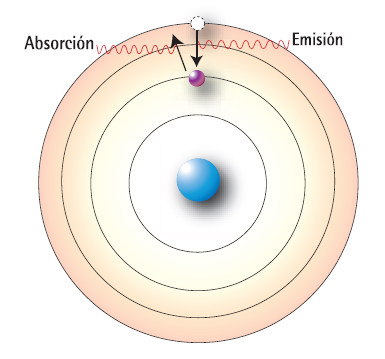
Modelo atómico de Bohr.
Estos postulados fueron planteados por Bohr en relación con el átomo de hidrógeno, el más sencillo que se conoce. Sin embargo, el análisis de los espectros de emisión de otros átomos mostraba estructuras internas más complejas, que no eran explicadas satisfactoriamente por este modelo. Además, tampoco era claro por qué eran posibles sólo ciertas órbitas y por qué había discrepancias tan grandes entre las órbitas de diferentes átomos.
El modelo de Sommerfeld
Algunos años después, espectroscopios más sensibles, permitieron observar que algunas de las líneas que formaban los espectros de emisión estaban en realidad compuestas de varias líneas más finas, lo cual hizo pensar que existían estados energéticos intermedios, entre los orbitales propuestos por Bohr.
Arnold Sommerfeld (1868-1951), físico alemán, propuso en 1916, una ligera modificación al modelo de Bohr, según la cual, existían órbitas elípticas, además de circulares, permitiendo la existencia de niveles y subniveles de energía.
Hacia un modelo mecánico-cuántico de la materia
La materia es ondulatoria
en 1924, el físico francés Louis de Broglie (1892-1977) planteó que si la energía podía ser particulada, la materia también podía entenderse como energía en forma de ondas. De esta suerte, para una partícula cualquiera, en movimiento, habría una onda asociada. De Broglie sintetizó esta idea en la siguiente ecuación:
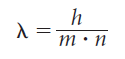
donde λ y ν describen la longitud y la frecuencia de la onda asociada, h es la constante de Planck y m es la masa de la partícula.
La ecuación de De Broglie implica que si m es grande, la longitud de onda es tan pequeña que no es perceptible. Mientras que, si m es tan pequeña como en un electrón, la onda asociada tiene una X elevada y medible. Esto explica que en nuestra experiencia diaria, la materia no aparente una naturaleza ondulatoria, como sí lo hace en el mundo subatómico.
El principio de incertidumbre de Heisenberg
De acuerdo con lo establecido por Bohr, el electrón del átomo de hidrógeno gira en torno al núcleo siguiendo una trayectoria bien definida, y por lo tanto es posible calcular su posición y cantidad de movimiento en cada punto. Sin embargo, en 1926, Werner Heisenberg (1901-1976) sostuvo que tal descripción no era posible, pues nuestra forma de observar y medir las cosas no nos permite hacerlo con completa objetividad. Así, siempre que observamos o medimos algo, afectamos al objeto observado. El resultado de esta premisa es que no es posible conocer simultáneamente la posición y la cantidad de movimiento (momento lineal) de una partícula subatómica, pues cuanto más exacta sea la estimación de un parámetro, menos podremos saber sobre el otro. De esta manera ya no se emplean números absolutos sino probabilidades para referirse a cualquier parámetro que caracterice una partícula subatómica.

Erwin Schrodinger (1887-1961) contribuyó significativamente a la elaboración del modelo atómico actual, con la formulación de un sistema probabilístico para indicar la ubicación de un electrón cualquiera en la periferia de un átomo.


