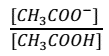Las disoluciones reguladoras, también llamadas tampón, tienen la cualidad de mantener su pH prácticamente constante, aun cuando se diluyan o se agreguen cantidades moderadas de ácidos o bases. Estas disoluciones están formadas por:
- Un ácido débil y una sal que contiene su base conjugada. Por ejemplo:
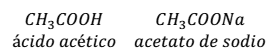
- Una base débil y una sal que contiene su ácido conjugado. Por ejemplo:
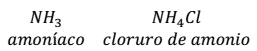
Regulación del pH
Si se tiene una disolución formada por un ácido débil y una sal que contiene su base conjugada, y a esta se le añade una pequeña cantidad de ácido, la concentración de H3O+ aumenta. Por ejemplo:
El ácido acético es un ácido débil que se disocia parcialmente:
![]()
El acetato de sodio es un electrolito fuerte que se disocia totalmente
![]()
La constante de equilibrio para el ácido será:
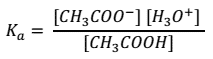
| Si a esta disolución de le agrega un ácido, como el ácido clorhídrico (HCl) aumenta la concentración de H3O+ provocando la disminución de la relación.
El sistema se desplaza a la izquierda aumentando la concentración de ácido acético y disminuyendo la concentración de acetato. | Si a esta disolución de le agrega una base, como el hidróxido de sodio (NaOH), disminuye la concentración e H3O+, provocando el aumento de la relación
El sistema se desplaza a la derecha. |