Como recordarás, materia es todo lo que nos rodea, es todo aquello que tiene masa y ocupa un lugar en el espacio. La química es la ciencia que estudia la materia, sus propiedades, su constitución cualitativa y cuantitativa, los cambios que experimenta, así como las variaciones de energía que acompañan a las transformaciones en las que interviene.
Qué es la Materia
Desde tiempos remotos el hombre ha tratado de describir el mundo que lo rodea a partir de observaciones y experimentaciones. El aire, el agua, la tierra y todo lo que conocemos y utilizamos está formado de materia. La materia se define como, todo lo que ocupa un lugar en el espacio y posee masa cuantificable.
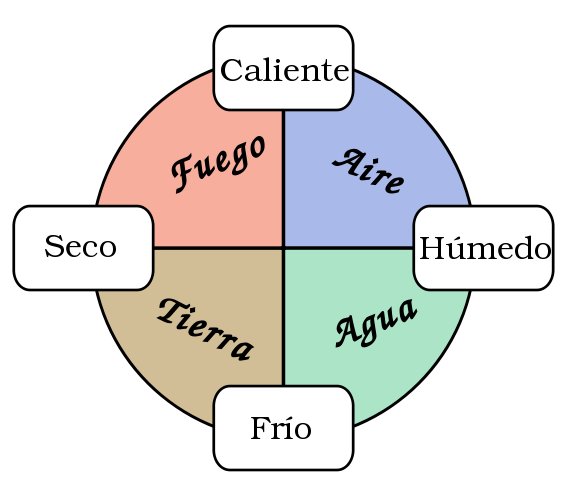
El primer intento de descripción de la materia se remonta a los griegos, Aristóteles propone la existencia de los “4 elementos” (Agua, Fuego, Tierra y Aire) a partir de los cuales se formaban todas las sustancias conocidas.
El filósofo griego Demócrito propuso la existencia de una unidad fundamental en la materia, los átomos. Postuló, entre otras cosas, que éstos eran indivisibles e imperturbables y no podían ser creados ni destruidos. En aquel tiempo se concebía que el átomo como la porción de materia más pequeña, sin embargo nada se conocía respecto de su conformación, composición y estructura.
Por lo tanto, la Materia es todo lo que ocupa espacio, tiene una propiedad llamada masa y posee inercia. Cada ser humano es un objeto material. Todos ocupamos espacio y describimos nuestra masa por medio de una propiedad relacionada con ella, el peso. Todos los objetos que vemos a nuestro alrededor son objetos materiales.

Los gases de la atmósfera, aunque invisibles, son ejemplos de la materia, ocupan espacio y tienen masa.
La Materia está formada por componentes. Una muestra de materia posee componentes determinados.

Por ejemplo: El agua está formada por dos sustancias simples, hidrógeno y oxígeno, presentes en determinadas proporciones fijas. Un químico diría que la composición en masa del agua es de 11,19 por ciento de hidrógeno y 88,81 por ciento de oxígeno.
Propiedades de la Materia
Propiedades generales o extrínsecas
Las propiedades generales son las propiedades comunes a toda clase de materia; es decir, no nos proporcionan información acerca de la forma como una sustancia se comporta y se distingue de las demás. Las propiedades generales más importantes son:
- Masa, cantidad de materia que tiene un cuerpo.
- Volumen, espacio que ocupa un cuerpo.
- Peso, resultado de la fuerza de atracción o gravedad que ejerce la Tierra sobre los cuerpos.
- Inercia, tendencia de un cuerpo a permanecer en estado de movimiento o de reposo mientras no exista una causa que la modifique y se relaciona con la cantidad de materia que posee el cuerpo.
- Impenetrabilidad, característica por la cual un cuerpo no puede ocupar el espacio que ocupa otro cuerpo al mismo tiempo.
- Porosidad: es la característica de la materia que consiste en presentar poros o espacios vacíos.
Propiedades específicas o intrínsecas
La materia también posee propiedades y corresponde a las cualidades y atributos que podemos utilizar para distinguir una muestra de materia de otra. Las propiedades de la materia se agrupan generalmente en dos categorías: Propiedades Físicas y Propiedades Químicas.
Las propiedades específicas son características de cada sustancia y permiten diferenciar un cuerpo de otro. Las propiedades específicas se clasifican en propiedades físicas y propiedades químicas.
Propiedades físicas
Son las que se pueden determinar sin que los cuerpos varíen su naturaleza. Entre las propiedades físicas se encuentran:
- Propiedades organolépticas: son aquellas que se determinan a través de las sensaciones percibidas por los órganos de los sentidos. Por ejemplo, el color, el olor, el sabor, el sonido y la textura.
- Estado físico es la propiedad de la materia que se origina por el grado de cohesión de las moléculas. La menor o mayor movilidad de las moléculas caracteriza cada estado.
- Punto de ebullición: es la temperatura a la cual una sustancia pasa del estado líquido al estado gaseoso.
- Punto de fusión: es la temperatura a la cual una sustancia pasa del estado sólido al estado líquido.
- Solubilidad: es la propiedad que tienen algunas sustancias de disolverse en un líquido a una temperatura determinada.
- Densidad: es la relación que existe entre la masa de una sustancia y su volumen. Por ejemplo, un trozo de plomo pequeño es más denso que un objeto grande y liviano como el corcho.
- Dureza: es la resistencia que oponen las sustancias a ser rayadas. Se mide mediante una escala denominada escala de Mohs que va de uno hasta diez. Así, por ejemplo, dentro de esta escala el talco tiene una dureza de uno (1), mientras que el diamante presenta un grado de dureza de diez (10).
- Elasticidad: es la capacidad que tienen los cuerpos de deformarse cuando se aplica una fuerza sobre ellos y de recuperar su forma original cuando la fuerza aplicada se suprime.
- Ductilidad: mide el grado de facilidad con que ciertos materiales se dejan convertir en alambres o hilos.
- Maleabilidad: mide la capacidad que tienen ciertos materiales para convertirse en láminas, como el cobre o el aluminio. En general, los materiales que son dúctiles también son maleables.
- Tenacidad: es la resistencia que ofrecen los cuerpos a romperse o deformarse cuando se les golpea. Uno de los materiales más tenaces es el acero.
- Fragilidad: es la tendencia a romperse o fracturarse.
Propiedades químicas
Son las que determinan el comportamiento de las sustancias cuando se ponen en contacto con otras. Cuando determinamos una propiedad química, las sustancias cambian o alteran su naturaleza Por ejemplo, cuando dejamos un clavo de hierro a la intemperie durante un tiempo, observamos un cambio que se manifiesta por medio de una fina capa de óxido en la superficie del clavo. Decimos entonces que el clavo se oxidó y esto constituye una propiedad química tanto del hierro como del aire; el primero por experimentar una oxidación y el segundo por producirla.
Algunas propiedades químicas son:
- Combustión: es la cualidad que tienen algunas sustancias para reaccionar con el oxígeno, desprendiendo, como consecuencia, energía en forma de luz o calor.
- Reactividad con el agua: algunos metales como el sodio y el potasio reaccionan violentamente con el agua y forman sustancias químicas denominadas hidróxidos o bases.
- Reactividad con las sustancias ácidas: es la propiedad que tienen algunas sustancias de reaccionar con los ácidos. Por ejemplo, el magnesio que es un metal, reacciona con el ácido clorhídrico para formar hidrógeno gaseoso y una sal de magnesio.
- Reactividad con las bases: es la propiedad que poseen ciertas sustancias de reaccionar con un grupo de compuestos químicos denominados bases o hidróxidos. Así, por ejemplo, la formación de la sal común o cloruro de sodio (NaCl) se debe a la reacción entre el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH).
En resumen, una Propiedad Física es una propiedad que una muestra de materia tiene mientras no cambie su composición. En cambio una Propiedad Química, es la capacidad de una muestra de materia para experimentar un cambio en su composición bajo ciertas condiciones.
Transformaciones de la materia
Transformaciones físicas
Son aquellas transformaciones o cambios que no afectan la composición de la materia. En los cambios físicos no se forman nuevas sustancias.
Se dan cambios físicos cuando ocurren fenómenos como los siguientes: el aroma de un perfume se esparce por la habitación al abrir el frasco que lo contiene; al añadir azúcar al agua, el azúcar se disuelve en ella. En estos ejemplos, el perfume se evapora y el azúcar se disuelve. Cada una de estas transformaciones se produce sin que cambie la identidad de las sustancias; sólo cambian algunas de sus propiedades físicas por lo que se dice que ha sucedido una transformación física.
También son cambios físicos, los cambios de estado, porque no se altera la composición o naturaleza de la sustancia. Los cambios de estado dependen de las variaciones en las fuerzas de cohesión y de repulsión entre las partículas. Cuando se modifica la presión o la temperatura, la materia pasa de un estado a otro. Veamos.
- Al aumentar la presión, las partículas de materia se acercan y aumenta la fuerza de cohesión entre ellas. Por ejemplo, un gas se puede transformar en líquido si se somete a altas presiones.
- Al aumentar la temperatura , las partículas de materia se mueven más rápido y, por tanto, aumenta la fuerza de repulsión entre ellas. Por ejemplo, si se calienta un líquido, pasa a estado gaseoso.
Son cambios de estado la fusión, la solidificación, la vaporización, la condensación y la sublimación.
- Fusión: es el paso del estado sólido al estado líquido.
- Solidificación: es el proceso inverso a la fusión, es decir, es el cambio del estado líquido al estado sólido.
- Vaporización: es el paso de líquido a gas por acción del calor.
- Condensación: es el proceso inverso a la evaporación, es decir, es el cambio de gas a líquido.
- Sublimación progresiva: es el paso del estado sólido al estado gaseoso sin pasar por el estado líquido.
- Sublimación regresiva: es el proceso inverso a la sublimación progresiva. Del estado gaseoso se pasa al estado sólido al bajar la temperatura.

Por Ejemplo : Cuando el agua líquida se congela formándose agua solida (hielo), sin duda el agua parece diferente y, en muchos sentidos, lo es. Sin embargo permanece inalterada la composición en masa del agua 11,19 por ciento de hidrógeno y 88,81 por ciento de oxígeno.
Transformaciones químicas
Son aquellas transformaciones o cambios que afectan la composición de la materia. En los cambios químicos se forman nuevas sustancias. Por ejemplo cuando ocurren fenómenos como los siguientes: un papel arde en presencia de aire (combustión) y un metal se oxida en presencia de aire o agua (corrosión), podemos decir que cambió el tipo de sustancia, convirtiéndose en otra diferente: por eso se dice que se produjo una transformación química.

Por ejemplo: Cuando se quema un papel tiene lugar una transformación química. Los componentes principales del papel son carbono, hidrógeno y oxígeno. Los productos principales de la combustión son dos gases, uno de ellos formado por carbono y oxigeno (dióxido de carbono) y el otro por hidrógeno y oxigeno (agua en forma de vapor). La capacidad de arder del papel es un ejemplo de propiedad química.
En las transformaciones químicas se producen reacciones químicas. Una reacción química se da cuando dos o más sustancias entran en contacto para formar otras sustancias diferentes. Es posible detectar cuándo se está produciendo una reacción química porque observamos cambios de temperatura, desprendimiento de gases, etc.
En resumen. En una transformación física pueden cambiar algunas de las propiedades físicas de la muestra de materia pero su composición permanece inalterada, en cambio en una transformación química, una o más muestras de materia se convierten en nuevas muestras con composiciones diferentes. Por tanto, la clave para identificar una transformación química es observar un cambio en la composición.
Clases de materia
La materia puede presentarse como una sustancia pura o como una mezcla.
Las sustancias puras
Una sustancia pura es aquella compuesta por un solo tipo de materia, presenta una composición fija y se puede caracterizar por una serie de propiedades específicas.

Por ejemplo, al analizar una muestra pura de sal común siempre encontramos los mismos valores para propiedades tales como la solubilidad (36 g/100 cm3 a 20 °C), la densidad (2,16 g/cm3) y el punto de fusión (801 °C). Los valores de las propiedades específicas de las sustancias puras siempre son los mismos.
Las sustancias puras no pueden separarse en sus componentes por métodos físicos. Según la composición química, las sustancias puras se clasifican en: sustancias simples o elementos químicos, y sustancias compuestas o compuestos químicos.
Elemento químico
Un elemento químico es una sustancia pura, que no puede descomponerse en otras más sencillas que ella. El hierro, el oro y el oxígeno son ejemplos de elementos químicos, ya que no pueden descomponerse en otras sustancias diferentes a ellos.
Los elementos químicos se representan mediante símbolos. Los símbolos siempre empiezan con una letra mayúscula. En algunos casos el símbolo corresponde a la letra inicial del nombre del elemento, por ejemplo, carbono (C) y oxígeno (O). En otros casos, se simboliza con la letra inicial del elemento en mayúscula, seguida por una segunda letra del nombre que siempre es minúscula, por ejemplo, cesio (Cs) y magnesio (Mg).
Hay algunos elementos cuyos nombres latinos o griegos no coinciden con los españoles y de ahí que haya símbolos que no tienen relación con el nombre en español del elemento, por ejemplo, el hierro (Fe), del latín ferrum.
Los elementos químicos se clasifican en dos grandes grupos: los metales y los no metales.
Compuesto químico
Un compuesto químico es una sustancia pura, formada por la combinación química de dos o más elementos, en proporciones definidas. Por ejemplo, 1 g de cloruro de sodio siempre contiene 0,3934 g de sodio y 0,6066 g de cloro, combinados químicamente. Los compuestos se representan por medio de fórmulas. Una fórmula química muestra los símbolos de los elementos que forman el compuesto, y la proporción que existe entre ellos, es decir, señalan su composición química. Por ejemplo, la fórmula del agua es H2O, lo que indica que esta sustancia está formada por hidrógeno y oxígeno en una proporción de 2:1.
Un elemento químico es una sustancia formada por un solo tipo de átomos. Los compuestos químicos son sustancias en las que se combinan entre si átomos de diferentes elementos químicos. Actualmente se han identificado millones de compuestos químicos diferentes.
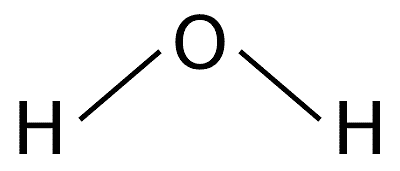
Por ejemplo: Una molécula de agua está formada por tres átomos: dos átomos de hidrógeno unidos a un solo átomo de oxígeno.
Los compuestos se pueden clasificar en dos grandes grupos:
- Los compuestos orgánicos: son aquellos que tienen al carbono como elemento principal combinado con elementos como el hidrógeno, oxígeno y nitrogeno. Los carbohidratos, los lípidos y las proteínas son ejemplos de compuestos orgánicos.
- Los compuestos inorgánicos: son aquellos que no tienen al carbono como elemento principal. El agua (H2O) y el cloruro de sodio (NaCl) son ejemplos de compuestos inorgánicos.
Las mezclas
Las mezclas son uniones físicas de sustancias en las que la estructura de cada sustancia no cambia, por lo cual sus propiedades químicas permanecen constantes y las proporciones pueden variar. Además, es posible separarlas por procesos físicos. Por ejemplo, la unión de agua con tierra es una mezcla.
En una mezcla, la sustancia que se encuentra en mayor proporción recibe el nombre de fase dispersante o medio, y la sustancia que se encuentra en menor proporción recibe el nombre de fase dispersa. De acuerdo con la fuerza de cohesión entre las sustancias, el tamaño de las partículas de la fase dispersa y la uniformidad en la distribución de estas partículas las mezclas pueden ser homogéneas o heterogéneas.
- Mezclas homogéneas: son aquellas mezclas que poseen la máxima fuerza de cohesión entre las sustancias combinadas; las partículas de la fase dispersa son más pequeñas, y dichas partículas se encuentran distribuidas uniformemente. De esta manera, sus componentes no son identificables a simple vista, es decir, se perciben como una sola fase. También reciben el nombre de soluciones o disoluciones.
- Mezclas heterogéneas: son aquellas mezclas en las que la fuerza de cohesión entre las sustancias es menor; las partículas de la fase dispersa son más grandes que en las soluciones y dichas partículas no se encuentran distribuidas de manera uniforme. De esta forma, sus componentes se pueden distinguir a simple vista. Por ejemplo, la reunión de arena y piedras forma una mezcla heterogénea. Las mezclas heterogéneas pueden ser suspensiones o coloides.
- Suspensiones: son las mezclas en las que se aprecia con mayor claridad la separación de las fases. Generalmente están formadas por una fase dispersa sólida insoluble en la fase dispersante líquida, por lo cual tienen un aspecto opaco y, si se dejan en reposo, las partículas de la fase dispersa se sedimentan. El tamaño de las partículas de la fase dispersa es mayor que en las disoluciones y en los coloides. Por ejemplo, el agua con arena es una suspensión.
- Coloides: son mezclas heterogéneas en las cuales las partículas de la fase dispersa tienen un tamaño intermedio entre las disoluciones y las suspensiones, y no se sedimentan. Las partículas coloidales se reconocen porque pueden reflejar y dispersar la luz. Por ejemplo, la clara de huevo y el agua jabonosa son coloides.
 >
> 