Cada elemento se caracteriza por un número atómico Z, el cual es igual al número de protones en su núcleo. Un átomo neutro tiene igual número de protones, los cuales tienen carga positiva, y de electrones, los cuales tienen carga negativa. Desde el momento de su descubrimiento, en 1887, se pensó que los electrones eran partículas, pero en 1924 el físico francés Louis de Broglie sugirió que también tenían comportamiento de onda.
Dos años después, Erwin Schrödinger dio el siguiente paso y calculó la energía de un electrón en un átomo de hidrógeno usando ecuaciones que trataban al electrón como si fuera una onda. En lugar de una sola energía, Schrödinger obtuvo una serie de niveles de energía, cada uno de los cuales correspondía a una descripción matemática diferente de la onda electrónica. Estas descripciones matemáticas se llaman funciones de onda y se simbolizan con la letra griega Ψ (psi).
De acuerdo con el principio de incertidumbre de Heisenberg, no se puede determinar con exactitud dónde está un electrón, pero sí se puede determinar dónde es más probable que esté. La probabilidad de encontrar un electrón en un punto particular en relación con el núcleo de un átomo está dada por el cuadrado de la función de onda Ψ2 (psi al cuadrado) en ese punto.

La figura ilustra la probabilidad de encontrar un electrón en varios puntos en el estado de menor energía (más estable) de un átomo de hidrógeno. Cuanto más oscuro es el color en una región, será mayor la probabilidad. La probabilidad de encontrar un electrón en un punto particular es mayor cerca del núcleo y disminuye con el aumento de la distancia del núcleo, pero nunca se vuelve cero. Esto se describe como una “nube electrónica” para hacer hincapié sobre la naturaleza extendida de la probabilidad del electrón.
Las funciones de onda también se conocen como orbitales. Por conveniencia, los químicos usan el término “orbital” de varias formas. Con frecuencia se dice que un dibujo como el de la figura anterior representa un orbital. Los orbitales se describen al especificar su tamaño, forma y propiedades direccionales. Los que son simétricos en forma esférica, como el de la figura anterior, se llaman orbitales s. La letra s es precedida por el número cuántico principal n (n = 1, 2, 3, etc.), el cual especifica el nivel y se relaciona con la energía del orbital. Es probable que un electrón en un orbital 1s se encuentre más cerca del núcleo, tenga menos energía y se sostenga con más fuerza que un electrón en un orbital 2s.

En lugar de representar los orbitales con distribuciones de probabilidad, es más común representarlos por sus contornos de superficie, como se muestra en la figura, para los orbitales 1s y 2s. El contorno de superficie encierra la región donde la probabilidad de encontrar un electrón es alta, del orden de 90-95%. Al igual que el gráfico de distribución de probabilidad del que se deriva, una ilustración de un contorno de superficie, por lo general, se describe como el dibujo de un orbital.
Un átomo de hidrógeno (Z = 1) tiene un electrón; un átomo de helio (Z = 2) tiene dos. El electrón único del hidrógeno ocupa un orbital 1s, al igual que los dos electrones de helio. Sus configuraciones electrónicas se escriben como:
Hidrogeno: 1s1
Helio : 1s2
Además de tener carga negativa, los electrones poseen la propiedad de espín. El número cuántico de espín de un electrón puede tener un valor ya sea de +1/2 o -1/2 . De acuerdo con el principio de exclusión de Pauli, dos electrones pueden ocupar el mismo orbital sólo cuando tienen espines opuestos, o espines “apareados”. Por esta razón, ningún orbital puede contener más de dos electrones. Debido a que dos electrones llenan el orbital 1s, el tercer electrón en el litio (Z = 3) debe ocupar un orbital de mayor energía. Después del orbital 1s, el siguiente de mayor energía es el orbital 2s. Por consiguiente, el tercer electrón en el litio ocupa el orbital 2s, y la configuración electrónica del litio es :
Litio: 1s2 2s1
El periodo (o fila) de la tabla periódica en que aparece un elemento corresponde al número cuántico principal más alto en el que hay un orbital ocupado (n = 1 en el caso del hidrógeno y el helio). El hidrógeno y el helio son elementos de la primera fila; el litio (n = 2) es un elemento de la segunda fila. En la tabla se muestran las configuraciones electrónicas de los primeros 12 elementos, de hidrógeno a magnesio. Observe que, en el llenado de los orbitales 2p, cada uno se ocupa por un solo electrón antes que cualquiera se ocupe en forma doble. Este principio general para los orbitales de la misma energía se conoce como regla de Hund.
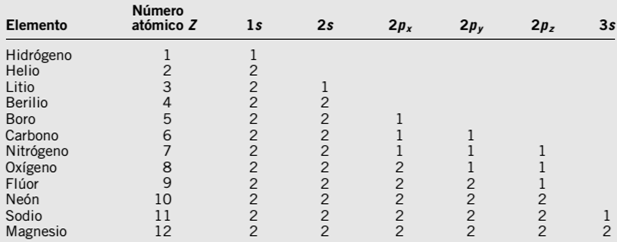
Con frecuencia es conveniente hablar de los electrones de valencia de un átomo. Éstos son los electrones externos, aquellos que tienen más probabilidad de estar implicados en enlaces y reacciones químicos. Para los elementos de la segunda fila éstos son los electrones 2s y 2p. Debido a que están implicados cuatro orbitales (2s, 2px , 2py , 2pz), el número máximo de electrones en la capa de valencia de cualquier elemento de la segunda fila es 8. El neón, con todos sus orbitales 2s y 2p ocupados doblemente, tiene ocho electrones de valencia y completa la segunda fila de la tabla periódica. Para los elementos del grupo principal, el número de electrones de valencia es igual al número de su grupo en la tabla periódica.
El neón, en el segundo periodo, y el argón, en el tercero, tienen ocho electrones en su capa de valencia; se dice que tienen un octeto completo de electrones. El helio, el neón y el argón pertenecen a la clase de elementos conocida como gases nobles o gases raros. Los gases nobles se caracterizan por tener configuración electrónica de “capa completa” estable en extremo y son muy poco reactivos.
La estructura determina las propiedades y las propiedades de los átomos dependen de la estructura atómica. Todos los protones de un elemento están en su núcleo, pero los electrones del elemento están distribuidos en orbitales de diferente energía y a distancias variables del núcleo. Cuando se desea entender cómo se comporta un elemento, más que cualquier otra cosa, se observa su configuración electrónica.
Configuración Electrónica
Se llama configuración electrónica al grupo de números cuánticos que describen la posición de todos los electrones para un estado basal o fundamental del átomo, así como de ion determinado. Antes de establecer la configuración electrónica para cada elemento es necesario tener las siguientes consideraciones:
- En un átomo eléctricamente neutro el número de protones (cargas positivas) debe ser igual al número de electrones (cargas negativas), Cualquier diferencia entre ellos se debe al exceso o déficit de electrones. El número de protones se mantiene constante.
- El número de protones es variable para cada tipo de elemento químico, aunque es constante para todos los átomos del mismo elemento.
- El número de protones que posee cada elemento químico se conoce como número atómico (Z).
Principios Que Rigen La Configuración Electrónica
- Principio de máxima multiplicidad o de Hund: Los múltiples electrones de un nivel energético secundario están en su menor estado de energía potencial cuando tienen el mismo spin.
- Principio de exclusión de Pauli: Dos electrones no pueden estar en un mismo estado en un átomo, es decir, no pueden tener sus cuatro números cuánticos iguales.
- Principio de Aufbau: Los electrones se agregan al átomo, partiendo del orbital de menor energía hacia los de mayor energía.
Tomando en cuenta estos principios, podemos decir que el número máximo de electrones que puede tener cada nivel energético secundario es:
| orbital | número de electrones |
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
El número máximo de electrones que puede tener cada nivel energético es:
| nivel | número de electrones |
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
| 5 | 32 |
| 6 | 18 |
| 7 | 8 |
La energía del electrón depende tanto de n como del subnivel l donde se encuentra el electrón. Y así el valor de esta energía es proporcional a la suma de los dos números cuánticos que los representa: (n + l). Por lo tanto, el electrón se ubicará siempre donde exista menor energía, y, si la suma para dos posiciones son iguales, se le asigna mayor energía al que tenga mayor valor de n.
Números cuánticos desde el hidrógeno hasta el oxígeno (Z = 8).
| 1s | 2s | 2px | 2py | 2pz | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | 1 | 1 | 2 | 2 | 2 | 2 | 2 | 2 | ||
| l | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | ||
| m | 0 | 0 | 0 | 0 | -1 | -1 | 0 | +1 | ||
| s | +1/2 | -1/2 | +1/2 | -1/2 | +1/2 | -1/2 | +1/2 | +1/2 | ||
| N° de electrón | 1 | 2 | 3 | 4 | 5 | 8 | 6 | 7 | ||
La asignación de los valores -1,0 y +1 de los orbitales px, py y pz son arbitrarias.
Ejemplos:
| 1H | 1 protón |
| 1 electrón | |
| Carga: neutra | |
| Configuración Electrónica : 1s1 | |
| 2He | 2 protones |
| 2 electrones | |
| Carga: neutra | |
| Configuración Electrónica : 1s2 | |
| 13Al | 13 protones |
| 13 electrones | |
| Carga: neutra | |
| Configuración Electrónica: 1s2 2s2 2p6 3s2 3p1 | |
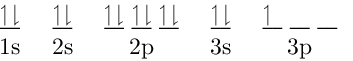 |
| 20Ca2+ | 20 protones |
| 18 electrones | |
| Carga = 2+ | |
| Configuración Electrónica: 1s2 2s2 2p6 3s2 3p6 | |
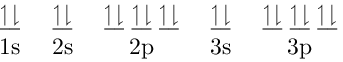 |
Cuando existen dos electrones en un mismo orbital deben girar en sentido contrarios, pues de esa forma la atracción electromagnética generada entre ambos contrarresta la repulsión electrostática y puedan permanecer apareados en la misma región espacial.

Este esquema ayuda a recordar el orden de distribución de los electrones por niveles y subniveles.
Otra forma de escribir las configuraciones electrónicas se puede hacer abreviadamente, utilizando el gas noble anterior al elemento. Los gases nobles presentan completos los subniveles s y p (ns2np6). Por esta razón los gases nobles no son reactivos y tienen su configuración electrónica estable. Estos elementos se utilizan para realizar una configuración electrónica resumida.
Sabemos que la configuración del 10 Ne (gas noble) es:
1s22s2 2p6
Por lo tanto, la configuración electrónica resumida del 13 Al:
13Al = [10Ne] 3s2 3p1


